Traitements de la maladie de Parkinson et recherche
Les traitements
Il n’existe aucun traitement curatif de la maladie de Parkinson. Les médicaments utilisés visent à compenser le déficit en dopamine. Ces traitements sont uniquement symptomatiques c'est à dire qu'ils permettent d'atténuer voire de supprimer les manifestations de la maladie mais ils n'interviennent pas sur son évolution.
Les médicaments reposent sur la connaissance du métabolisme de la dopamine et de son mode d'action au niveau des synapses.
Étude préalable du métabolisme dopaminergique et des récepteurs synaptiques de la dopamine
La dopamine fait partie de la famille des catécholamines, composés organiques synthétisés à partir de l'acide aminé tyrosine et jouant le rôle d'hormone ou de neurotransmetteur. Les plus courantes de ces catécholamines sont l'adrénaline et la noradrénaline obtenues à partir de la dopamine. La dopamine est le composé le plus simple de cette famille de molécules, caractérisées par la présence d'un noyau catéchol.
La synthèse de la dopamine :
Elle est réalisée à partir de la tyrosine dont le noyau benzénique est hydroxylé par la tyrosine hydroxylase (TH). On obtient ainsi la DOPA (dihydroxyphénylalanine) caractérisée par son noyau pyrocatéchol (dihydroxy-1,2 benzène), commun aux catécholamines (en rouge sur le schéma ci-dessous). La dopamine est ensuite obtenue par décarboxylation de la DOPA réalisée par la DOPA -décarboxylase (DC).
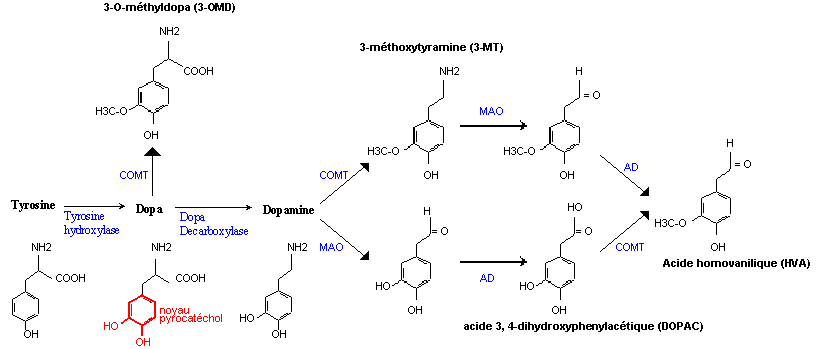
Biosynthèse et catabolisme de la dopamine : MAO = monoamine oxydase. COMT= catéchol-O-méthyl-transférase.
AD= aldéhyde déshydrogénase. (D'après le site de l'université médicale de Rennes)
Le catabolisme de la dopamine :
Deux enzymes interviennent dans l'espace synaptique pour inactiver la dopamine.
- La catéchol-O-méthyl-transférase ou COMT catalyse la méthylation d'un groupement hydroxyle (ajout d'un groupement méthyl CH3). Il se forme alors de la 3- méthoxytyramine (3-MT).
- La monoamine oxydase ou MAO réalise l'hydrolyse du radical amine de la dopamine. Cette enzyme existe sous deux formes : la MAO-A et la MAO- B. La MAO-B prédomine dans le cerveau, la forme A est présente aussi dans le foie et le tube digestif (les deux formes sont présentes dans la membrane externe des mitochondries).
Signalons que COMT et MAO agissent sur l'ensemble des catécholamines.
Au final, l'action des enzymes COMT et MAO à laquelle s'ajoute celle d'une aldéhyde déshydrogénase ou AD conduit à la formation d'acide homovalinique (HVA) à partir de la dopamine. ( Voir schéma ci-dessus).
Les récepteurs dopaminergiques :
L'action de la dopamine passe par l'intermédiaire de sa fixation sur ses récepteurs post-synaptiques. On connait actuellement 5 types de récepteurs : les récepteurs D1, D2, D3, D4 et D5.
Les récepteurs D1 sont ubiquitaires, corticaux et sous-corticaux et seraient impliqués dans l'activité motrice et la mémoire du travail. Ceux du striatum (noyau caudé et putamen) sont activés par la dopamine.
Les récepteurs D2 sont présents également dans le striatum et liés à la motricité mais inhibés par la dopamine.
Les D3, D4 et D5 sont surtout localisés au niveau du système limbique ce qui laisse présumer de leur implication dans certaines manifestations psychiatriques. Les D3 interviennent dans la motivation, le rôle des D4 et D5 est encore mal connu.
Lien entre la structure et l'activité de la dopamine :
La molécule de dopamine possède deux groupements hydroxyles (OH) séparés de l'atome d'azote par une distance de 7 à 8 angström. C'est cette configuration spatiale qui détermine l'activité biologique de la molécule. En pharmacologie, on nomme pharmacophore cette partie de la molécule responsable de son activité. Toute molécule possédant une analogie de structure avec le pharmacophore de la dopamine, pourra mimer l'action de la dopamine.
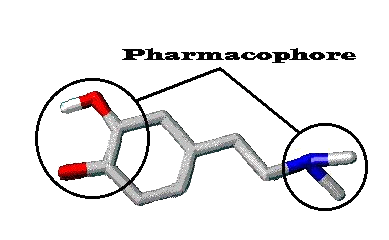
Représentation de la configuration spatiale de la dopamine montrant la structure du pharmacophore dopaminergique. En rouge, les deux groupements hydroxyles et en bleu, la fonction amine primaire. ( D'après le site de l' université médicale de Rennes )
Les principaux médicaments antiparkinsoniens
Pour compenser le déficit dopaminergique, plusieurs recours pharmacologiques sont possibles :
- apporter de la L-Dopa : c'est la dopathérapie
- mimer l'action de la dopamine sur les récepteurs dopaminergiques, on utilise alors des agonistes de la dopamine.
- Inhiber les enzymes du catabolisme de la dopamine comme la COMT ou la MAO-B pour diminuer sa dégradation, on utilise pour cela des inhibiteurs d'enzymes : ICOMT ou IMAO-B.
nbsp; 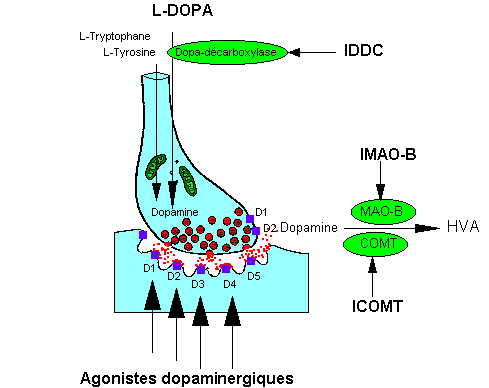
Représentation schématique des sites d'action des principaux médicaments antiparkinsoniens :
IDDC = inhibiteur de la dopadécarboxylase.
IMAO-B = inhibiteurs de la monoamine oxydase B.
ICOMT = inhibiteurs de la catéchol-O-méthyl transférase.
HVA = acide homovanilique
( D'aprés le site de l'université médicale de Rennes)
1. La dopathérapie et ses complications :
Elle permet d’atténuer, voire de faire disparaître les symptômes de la maladie. On utilise la L-dopa qui est un précurseur de la dopamine. Dans les neurones, la tyrosine (acide aminé) est transformée en dopa sous l’action d’une enzyme la tyrosine oxydase (TH) qui travaille à un rythme lent.
La dopa est transformée en dopamine sous l’effet d’une enzyme la dopa-carboxylase (DC). La dopamine peut encore est transformée en noradrénaline et adrénaline. L’ingestion directe de dopa amène à une utilisation dans l’estomac, le foie, les reins et seule 1 % de la dose arrive au striatum. La L-dopa est le plus souvent associée à un inhibiteur de la DC ce qui permet d’économiser 80 % de la L-dopa. La L-dopa peut franchir la barrière hémato-céphalique ce qui n’est pas le cas de la dopamine et de l&rsqursquo;inhibiteur de la DC. Dans le striatum la L-dopa est transformée en dopamine. L’effet maximum est obtenu en 30 minutes à 2 heures. Après 6 heures les effets sont nuls. Cependant, il faut être patient car les effets bénéfiques de la L-dopa ne se font sentir qu’après deux ou trois mois de traitement.
Malheureusement, si la dopathérapie atténue les symptômes de la maladie, elle est aussi à l’origine de complications motrices qui font apparaître de nouveaux symptômes qui s’ajoutent à ceux de la maladie. Ceci a fait dire qu’il existait en fait deux maladies, la maladie de Parkinson sans L-dopa et la maladie de Parkinson avec L-Dopa.
En effet, après deux à cinq années de traitement, le médicament est de moins en moins efficace. Les patients commencent à ressentir des périodes de fluctuation de leur motricité. Des épisodes de rigidité invalidante et de tremblements incontrôlables alternent avec des périodes d’amélioration de la motricité.
Au cours des années, ces périodes de fluctuations motrices s’intensifient, on parle alors d’effet « ON/OFF ». La phase « ON » est l’état de bien être moteur et la phase « OFF » l’état de retour des symptômes parkinsoniens. Ce phénomène est extrêmement spectaculaire car le passage d’un état à l’autre se fait en quelques secondes. C’est un stade de la maladie où il devient difficile d’équilibrer le traitement.
Des mouvements anormaux involontaires apparaissent, on les appelle des dyskinésies. C’est ainsi que le malade est affligé de contorsions et de crampes brutales et douloureuses qui peuvent concerner toutes les parties du corps. Au cours de son sommeil, le patient peut ressentir le besoin de se lever et de marcher : c’est le syndrome « des jambes sans repos ». Plus on administre de L-dopa, plus on accentue les dyskinésies.
Les autres effets indésirables : la L-dopa peut également provoquer des troubles digestifs qui se traduisent par des nausées et des vomissements. Elle a aussi des effets psychiques plutôt bénéfiques puisque le patient devient plus alerte, plus attentif : c’est « l’éveil » qui fait suite à la dopathérapie dans le traitement des syndromes parkinsoniens post-encéphaliques. La dépression peut même disparaitre. Le sommeil peut-être perturbé par des cauchemars au cours desquels le malade crie et gesticule. Dans de rares cas il peut y avoir des hallucinations.
2. Les agonistes dopaminergiques
A coté de la dopathérapie, on utilise des agonistes dopaminergiques. Plutôt que de remplacer la dopamine, ces médicaments stimulent directement la zone qui réagit habituellement à la dopamine. Ils sont capables de se fixer sur les récepteurs de la dopamine. La durée d’action est conséquente et on peut viser l’amélioration de certains symptômes du fait de leur action qui peut être très spécifique ; il existe différents types de récepteur à la dopamine qui peuvent être spécifiquement stimulés par des agonistes différents.
On connaît deux classes de molécules pouvant jouer ce rôle :
- Les plus anciens sont dérivés de l'ergot du seigle, ce sont les ergopeptines
- la Bromocriptine : c'est le pus ancien agoniste, il stimule les récepteurs D2 .
- la Pergolide : c'est l'agoniste le plus puissant aprés l'apomorphine, c'est un agoniste D1 et D2.
- la Cabergoline : c'est un agoniste D2 qui a une durée d'action trés longue (demi-vie : 65 heures) qui assure une stimulation dopaminergique particulièrement stable.
- Les agonistes plus récents sont des composés synthétiques plus spécifiques des récepteurs D2. Cependant, Ils possèdent comme la L-Dopa des effets psychiatriques ( confusion, hallucinations). Ces effets seraient liés à une stimulation des récepteurs cortico-limbiques D3 et D4.
- L' Apomorphine : c'est un dérivé hémisynthétique de l'opium, utilisable seulement par voie injectable sous-cutanée car il est totalement détruit par le foie après administration par voie orale. Sa durée d'action est très faible (une heure), il est donc utilisé pour corriger les fluctuations brutales de l'état moteur du patient, notamment lorsqu'il souffre d'un effet on-off invalidant. Dérivée de la morphine, cette molécule n'en a pas les propriétés de stupéfiant et ressemble comme une sœur jumelle à la dopamine.
- Le Ropinirole : c'est un agoniste D2 mais aussi D3 et D4 ; Il serait plus efficace que la bromocriptine. Sa commercialisation est récente.
Tous ces produits semblent cependant moins efficaces que la L-Dopa, ce que leur faible homologie de struture avec la dopamine pourrait expliquer. (voir schéma ci dessous)
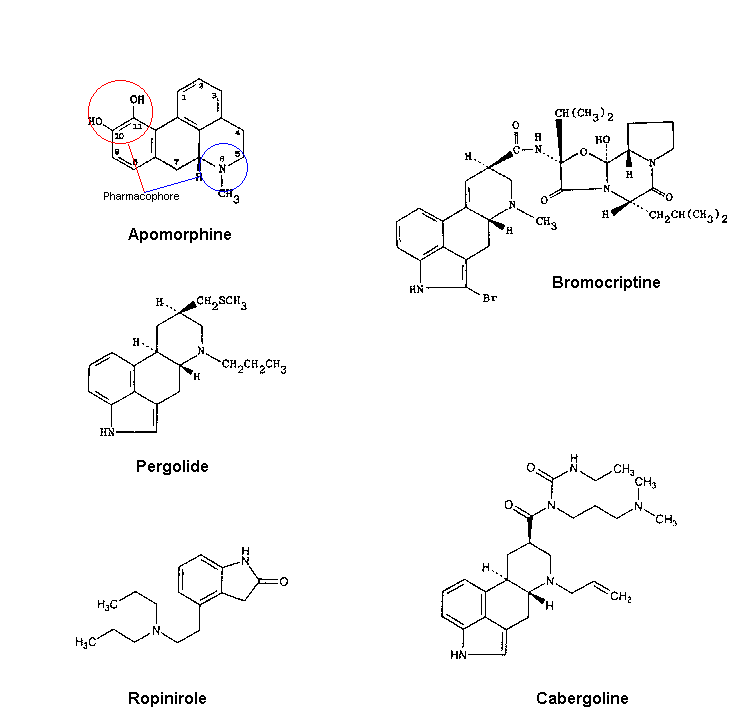
Quelques agonistes de la dopamine (D'aprés le site de l'université médicale de Rennes)
3. Les inhibiteurs d'enzymes
Ces molécules ont pour effet de prolonger l'effet de la L-DOPA en inhibant sa dégradation par deux enzymes : la COMT et la MAO-B.
Les inhibiteurs de la COMT (ICOMT) sont des inhibiteurs compétitifs (ils se fixent dans le site actif de l'enzyme). Ils sont toujours administrés en association avec la L-DOPA dont ils prolongent la durée d'action, ce qui permet une économie de 20% de la dose totale quotidienne. Actuellement, seul l'entacapone (Comtan) est commercialisé, le tolcapone (Tasmar) inhibiteur le plus puissant de la COMT a été disponible en 1998 mais rapidement sa commercialisation a été abandonnée car il a été mis en cause dans trois cas d'hépatite mortelle (il reste disponible en Suisse et aux États- Unis).
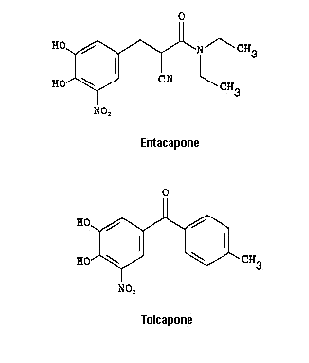
Structure chimique des deux principaux ICOMT.
Noter la parenté structurale de ces inhibiteurs compétitifs avec la dopamine.
(D'après le site de l'université médicale de rennes)
Les inhibiteurs de la MAO (IMAO) sont connus depuis de nombreuses années. La sélégiline (Déprényl) est un inhibiteur non compétitif de la MAO-B (il se fixe non pas sur le site actif mais sur une autre partie de la molécule et déforme le site actif). Associé à la dopathérapie, il en augmente l'effet de 20 à 30%. Les effets bénéfiques sont prolongés mais aussi les effets indésirables. Il peut être administré seul, même si son efficacité est alors plus modeste. Un hypothétique effet neuroprotecteur lui a été attribué,i l s'opposerait progressivement à la dégénérescence des neurones de la substance noire.Cet effet neuroprotecteur du Déprényl reste à prouver mais son effet antiparkinsonien ne fait aucun doute .
A coté de ces traitements liés au mode d'action de la dopamine, on utilise des médicaments anticholinergiques. Ils s'opposent à la neurotransmission dans les synapses où le neurotransmetteur est l"acétylcholine. Utilisés en France dés 1870 par Charcot, ils sont restés pendant prés d'un siècle les seuls médicaments antiparkinsoniens jusqu'à l'avènement de la L-Dopa. Particulièrement efficaces pour faire cesser les tremblements, ils ont malheureusement de nombreux effets secondaires : sécheresse buccale constipation, flou visuel, accélération du rythme cardiaque, troubles psychiques, hallucinations etc. Ces effets secondaires s'expliquent car de nombreux neurones contiennent de l'acétylcholine et pas seulement ceux du striatum. L'acétylcholine intervient dans le cortex cérébral en particulier dans les processus de mémorisation mais aussi dans le système nerveux parasympathique qui régule le fonctionnement de la plupart des viscères. Même s'ils sont de moins en moins prescrits, ils font toujours partie de l'arsenal thérapeutique de la maladie de Parkinson en particulier chez les sujets jeunes, en raison de leur efficacité à faire disparaître les tremblements.
La neurochirurgie
1. La thalathomie
Les neurochirurgiens savaient, bien avant la découverte des propriétés de la dopamine, que les parkinsoniens qui faisaient un accident vasculaire cérébral voyaient disparaître les tremblements dans la partie du corps atteinte par une paralysie modérée. C'est ainsi qu'on a justifié la recherche de zones cérébrales dont la destruction pouvait entraîner une une amélioration de certains symptômes parkinsoniens.
On a d’abord pratiqué, à partir des années 1960, des lésions au niveau du noyau ventral du thalamus ou thalathomie. Le thalamus peut en effet être considéré comme un petit cerveau à lui tout seul. C'est le relai obligatoire de la plupart des voies nerveuses qui relient la moëlle épinière et le tronc cérébral au cortex. Le noyau ventral du thalamus est la partie motrice de ce mini cerveau dont il existe un exemplaire dans chaque hémisphère cérébral.
La taille de cette cible étant très réduite, des techniques neurochirurgicales stéréotaxiques ont été rendues obligatoires afin de localiser la cible au millimètre prés. La chirurgie stéréotaxique est une technique qui permet de cibler avec une très haute précision des cibles, ou régions à l'intérieur du cerveau. Elle utilise un équipement de repérage appelé " cadre stéréotaxique " fixé à la tête du patient. Par analogie, la stréréotaxie traite le cerveau comme une carte géographique, elle est basée sur des coordonnées permettant la localisation en 3D.La première étape d'une chirurgie stéréotaxique consiste à fixer le cadre stéréotaxique , après quoi une technique d'imagerie de CT scanner ou IRM permet d'acquérir un volume tridimensionnel ou un point précis. La deuxième étape consiste à l'aide d'équipements, d'atteindre cette cible avec un risque d'erreur de moins de 1 millimètre. Une fois la cible repérée et les coordonnés établies à partir de l'imagerie, par une petite trépanation, on introduit une sonde dans le cerveau pour détruire la zone repérée.
Après destruction du noyau ventral du thalamus on constate que le tremblement est supprimé 8 fois sur 10 mais dans quelques cas, des effets indésirables sont constatés : déficits moteurs, affaiblissement intellectuel. Si les deux thalamus sont détruits, ces troubles atteignent presque la moitié des malades c'est pourquoi on ne pratique la thalatomie que du côté opposé à la parie du corps la plus atteinte.
A cause des risques encourus, cette technique très utilisée pendant 40 ans sur des dizaines de milliers de malades, a d'abord été reléguée au rang des méthodes historiques avec l'avènement de la dopathérapie, puis les inconvénients de la dopathérapie elle même ont entraîné un certain regain pour la thalatomie qui reste cependant réservée aux échecs médicamenteux.
2. A partir de 1992 : destruction du pallidum interne ou pallidotomie
Méthode trés utilisée aux Etats -Unis et en Suède. Les principaux symptômes moteurs parkinsoniens sont améliorés dans 30% des cas et les dyskinésies consécutives à la pallidotomie sont quasiment supprimées. Malgré cela, le traitement dopaminergique doit être maintenu.
3. La stimulation électrique profonde
Des travaux menés au CHU de Grenoble par le professeur Benabid ont montré qu’une stimulation électrique modifie le tremblement si l’électrode se trouve dans la cible idéale du thalamus. La stimulation à haute fréquence, au-delà de 100 Hz diminue ou supprime le tremblement. La stimulation à basse fréquence augmente le plus souvent le tremblement. C'est pourquoi,depuis 1987,des patients opérés ont été stimulés au niveau du thalamus , on a observé une disparition des tremblements dans 8 cas sur 10. Malheureusement, la stimulation du thalamus n'a pas d'effet sur sur l'akinésie ou sur les troubles de la marche. Cette technique est donc restée confidentielle mais elle a permis de montrer qu'on pouvait ajuster en permanence les paramètres de la stimulation et diminuer ainsi les effets indésirables ce que ne permet pas la technique de lésion du thalamus.
Les progrès des neurosciences et en particulier une meilleure compréhension du fonctionnement des ganglions de la base ont permis de faire évoluer la neurochirurgie et de la rendre plus efficace En effet, quand on a découvert que le déficit en dopamine à l'origine de l'akinésie s'accompagnait d'une hyperactivé du pallidum interne (GPI) et du noyau subthalamique (STN) on a alors exploré la destruction de la zone hyperactive ou sa stimulation à haute fréquence (ce qui revient à l'inhiber).
Stimulation du pallidum interne et du noyau subthalamique :
C'est la méthode la plus développée en France et dans les pays européens. Elle a été initiée au CHU de Grenoble en 1993. En particulier il est apparu que la cible subthalamique était la cible de choix. La stimulation bilatérale des noyaux subthalamiques permet en effet de diminuer, voire de supprimer le traitement dopaminergique. Son efficacité sur l'ensemble des signes moteurs de la maladie de Parkinson et notamment sur les dyskinésies fait que la stimulation du thalamus a été définitivement abandonnée. Selon une image utilisée par Marc Savasta (INSERM Grenoble) qui compare le fonctionnement de neurones des ganglions de la base à une œuvre musicale jouée par un orchestre, chez les parkinsoniens, certains de ces neurones sont hyperactifs ou hypoactifs la "cacophonie s'est installée dans l'orchestre". La stimulation permet de redonner la cadence aux neurones, comme un chef d'orchestre remet ses musiciens en cadence en tapant sur son pupitre.
La marche redevient possible, la rigidité et le tremblement peuvent disparaître, l'amélioration est chiffrée à au moins 60%de diminution sur des échelles d'invalidité motrice.
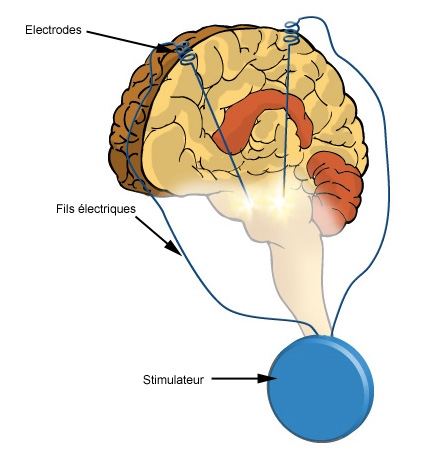

 Des précisions sur la technique de stimulation des noyaux subthalamiques :
Des précisions sur la technique de stimulation des noyaux subthalamiques :
1er temps : attacher un cadre de stéréotaxie sur le crâne du patient, sous anesthésie locale ou générale. Repérage de la cible grâce à l 'imagerie médicale par résonance magnétique (IRM). Des logiciels permettent de calculer la trajectoire d'implantation des électrodes vers la cible.
2ème temps : implantation des électrodes. Elle se fait sous anesthésie locale car la communication avec le malade est nécessaire. Rigidité et tremblements doivent disparaître sur la table d'opération afin de déterminer l'endroit où les électrodes seront implantées de façon définitive. Durée de l'opération : plusieurs heures.
3ème temps: Quelques jours après et sous anesthésie générale, un stimulateur est implanté sous la clavicule. Il est connecté à l'électrode crânienne par un fil glissé sous la peau. Rien n'est donc visible de l'extérieur. Un programmateur permet de régler le stimulateur depuis l'extérieur.
Le stimulateur électrique fonctionne en permanence, il doit être renouvelé en moyenne tous les 7 ans.
La plupart des patients sont opérés dans chaque hémisphère et dans ce cas, il y a un stimulateur de chaque côté.

Schéma d'une stimulation cérébrale profonde (D'aprés le dossier Santé du site de gsk) ©WWW.gsk.fr
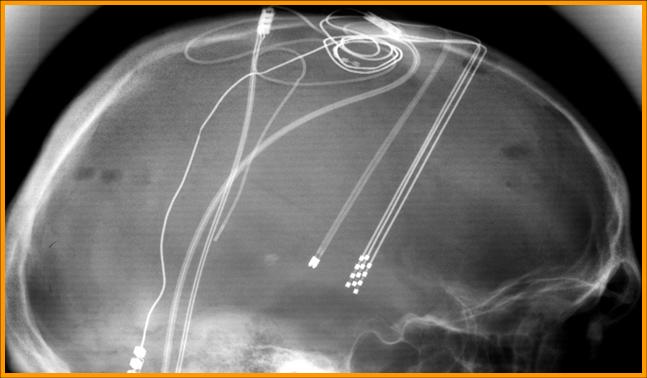
position des électrodes
photo Marc Savasta (INSERM Grenoble)
