spectroscopies
Définition de la spectroscopie
Les domaines de longueurs d'onde (et de fréquence) balayées par les techniques spectroscopiques sont larges: des rayons γ (gammagraphie) aux ondes radio (RMN) en passant par les ultraviolets , le visible (spectroscopies électroniques) et l'infrarouge (spectroscopie vibrationnelle et rotationnelle).
Etats d'énergie des molécules
- les niveaux rotationnels associés aux mouvements de rotation de la molécule autour de son centre d'inertie.
- les niveaux vibrationnels ; la liaison chimique est modélisée par un ressort; les atomes sont alors libres de vibrer autour d'une position d'équilibre.
- les états électroniques concernent la présence d'un électron dans telle ou telle orbitale moléculaire.
On peut donc écrire:
Transitions entre états d'énergie
Le tableau ci-dessous fait correspondre longueurs d'onde excitatrices avec différences d'énergie et méthodes spectroscopiques:
λ (nm) ΔE (eV) transition d'énergie domaine spectral 10 - 400 3 - 120 électroniques ultraviolets 400 -800 1,5 - 3 électroniques visible 800 - 105 1,2.10-2 - 1,5 vibration - rotation infrarouge
Un spectrophotomètre à simple faisceau (largement répandu dans les lycées) est constitué d'une source lumineuse (I0 désigne l'intensité lumineuse émise ou "incidente") , d'un monochromateur (ou d'un filtre), d'un emplacement où déposer la cuve (ou la pastille dans le cas de solides), d'une cellule photoélectrique qui détecte l'intensité lumineuse transmise It et un enregistreur.
Le schéma ci-dessous précise les notations I0 et It.
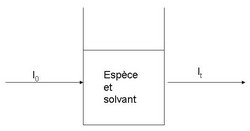
Un spectre UV-visible représente l'absorbance en fonction de la longueur d'onde. Un spectre infrarouge (spectre IR) représente la transmittance en fonction du nombre d'onde.
Exemples de spectres IR
- le spectre IR du méthane, CH4, est donné ci-dessous.
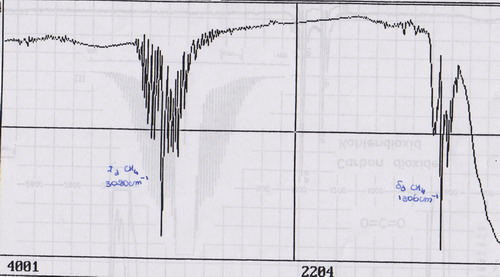
- le spectre IR du dioxyde de carbone, CO2, présente trois bandes d'absorption; ce qui prouve que c'est aussi un gaz à effet de serre.
- le spectre IR de la vapeur d'eau conduit à la même conclusion.
Sources: Chimie analytique, Skoog-West-Holler, éditions de Boeck
