Les mécanismes initiateurs de la puberté dans l'espèce humaine
Rédigée par Françoise Jauzein, ACCES 2003
Révisé en 2018
Les facteurs influençant l'âge de la puberté
Plusieurs facteurs influencent l'âge de la puberté :
- certains sont génétiques : similitude entre parents et enfants, frères et soeurs ou jumeaux monozygotes :
- d'autres sont liés aux conditions socio-économiques (quand elles sont bonnes à travers le monde, la ménarche intervient vers 12-13 ans), au niveau nutritionnel (la malnutrition retarde la puberté), au dégré d'activité physique (une certaine activité physique est bénéfique au développement somatique, mais la pratique du sport de compétition provoque un retard pubertaire (ménarche vers 15 ans )), et en rejoignent d'autres, d'ordre constitutionnel : poids corporel, relation masse grasse/masse maigre.
Les influences d'ordre ethniques ou climatiques sont minimes.
Il existe de nombreux cas de décalage de l'âge pubertaire.
Le retard pubertaire se définit comme l'absence de développement des caractères sexuels secondaires, à 13 ans chez la fille et à 14 ans chez le garçon. Quand il n'existe aucune cause d'anomalie fonctionnelle, on parle de retard pubertaire simple. Il est beaucoup plus fréquent chez le garçon que chez la fille, et s'accompagne d'un retard de maturation général (croissance ralentie et retard de l'âge osseux). L'étiologie correspond souvent à une dépense énergétique non compensée.
La puberté précoce se définit comme l'apparition du développement de caractères sexuels secondaires, avant 8 ans chez la fille et avant 10 ans chez le garçon. Il faut différencier les pseudo-pubertés précoces (dites aussi périphériques) qui sont dues à une sécrétion anormale de stéroïdes suite à une tumeur gonadique ou surrénalienne et qui régressent dès l'ablation de la tumeur, des pubertés vraies (ou centrales) dont l'origine peut être tumorale (tumeur hypothalamique secrétant de l'hCG) ou idiopathiques (sans causes décelables), beaucoup plus fréquentes chez les filles que chez les garçons.
Les hyperplasies surrénaliennes aboutissent à une accélération de croissance somatique (l'excès d'androgènes surrénaliens avance la maturité osseuse) qui entraîne une puberté précoce. De même, un apport calorique important et un développement rapide de la masse adipeuse pourraient expliquer la tendance à la précocité sexuelle observée actuellement dans l'espèce humaine. Enfin, la présence de certaines hormones dans des produits cosmétiques a également été invoquée comme facteur responsable de puberté précoce.
Puberté et sécrétion de GnRH
La puberté commence lors d'une augmentation de la sécrétion de gonadotropines (FSH et LH). Quels sont les facteurs qui contrôlent cette secrétion?
Au cours de la vie, il ya trois périodes dans la sécrétion des gonadotropines : la mise en fonctionnement des cellules gonadotropes hypophysaires chez le foetus, la régression de leur activité au cours de l'enfance et la reprise de leur activité au moment de la puberté. Comme ces trois phases se rencontrent aussi bien chez des individus normaux qu'agonadiques (ou chez des mammifères castrés) on peut conclure que l'absence de sécrétion de gonadotropines n'est pas dûe à un rétrocontrôle de la part des stéroides gonadiques.
De plus, il est possible de déclencher, chez le jeune impubère, par injections répétées de LH ou de GnRH avec une fréquence convenable, une induction précoce de l'ovulation et de la menstruation chez la fille ou de la spermatogénèse chez le graçon. Ces réponses peuvent également être obtenues par administration de glutamate, neuromédiateur excitateur induisant des décharges de GnRH. Cependant, à la fin des traitements, les effets s'estompent et la fonction gonadotrope redevient silencieuse ; la véritable puberté n'a pas été enclenchée.
Ainsi, l'ensemble des structures hypophysaires et gonadiques est prête à répondre, et c'est bien l'absence de sécrétion pulsatile de GnRH qui empêche le déclenchement de la puberté.
Dans le cas où l'hypothalamus est déconnecté du système nerveux central (soit à cause de tumeurs, soit par des lésions expérimentales de l'hypothalamus chez l'animal), on observe une puberté précoce. Ceci permet de conclure que le système nerveux central doit exercer un effet inhibiteur sur les neurones à GnRH de l'hypothalamus.
Il existe des cas de puberté précoce associés à des tumeurs de la glande pinéale (épiphyse), mais il n'y a pas d'arguments en faveur d'une influence de la mélatonine sur les sécrétions gonadotropes. Les retards ou les avances de la puberté suite à une injection de mélatonine ou une pinéalectomie, chez l'animal, ne sont que des décalages dans le déclenchement de la puberté mais n'empêchent jamais son apparition.
Les molécules impliquées dans le déclenchement pubertaire
L'hypothèse du contrôle de l'entrée en puberté par un "somatomètre" est basée sur le fait que la puberté dépend du poids corporel et de la masse adipeuse. Le somatomètre informerait en permanence le système nerveux central de l'état de de développement somatique de l'individu.
Plusieurs molécules peuvent rendre compte de cet état, et jouer le rôle de somatomètre : il s'agit de deux molécules impliquées dans la croissance, l'hormone de croissance GH et le facteur IGF-1, et d'une hormone sécrétée par le tissu adipeux, la leptine.
La leptine présente diverses caractéristiques qui font d'elle le meilleur candidat.
Sa sécrétion s'élève au début de la puberté tandis que celle de la GH continue tout au long de la croissance, jusqu'après la puberté.
Les souris obèses ob/ob (doublement mutée sur le gène "ob" de la leptine) sont stériles. On peut restaurer leur fonction gonadotrope en pratiquant des injections de leptine (chez les souris db/db -nle gène "db" code pour le récepteur de la leptine - présentant le même phénotype, ces injections sont sans effet, par manque du récepteur à la leptine). Quand, à l'inverse, la masse adipeuse est réduite par restriction alimentaire ou excès d'exercice physique, le niveau de leptine est également bas et la puberté est retardée. Une injection régulière de leptine permet de rétablir le processus pubertaire.
Ainsi, la leptine semble jouer un rôle essentiel dans le déclenchement de la puberté ; mais il s'agit seulement d'un rôle permissif car des injections de leptine à un animal normal (rat, macaque) n'avancent pas l'âge pubertaire.
Deux autres facteurs contrôlent également le démarrage de la puberté. Il s'agit du glutamate, neuromédiateur excitateur, et du GABA, neuromédiateur inhibiteur. Ces deux molécules semblent être directement impliquées dans l'initialisation de la puberté car le début de la puberté (chez le macaque) s'accompagne d'une augmentataion du taux de glutamate et une baisse du taux de GABA dans l'hypothalamus médian, en même temps que s'élève le contenu en GnRH.
|
Teneur de diverses molécules dans l'hypothalamus (éminence médiane, Macaque castré) |
Période de prépuberté |
Début de puberté |
Milieu de puberté |
|
GABA en pg/ml |
9 |
3 |
4 |
|
Glutamate en pg/ml |
80 |
180 |
120 |
|
GnRH en pg/ml |
2 |
3.5 |
6 |
De plus, l'administration d'un analogue du glutamate, le NMDA (N-méthyl-D-aspartate), avance la puberté chez l'animal (ratte, macaque). De même, l'inhibition de la synthèse du GABA dans l'éminance médiane (par blocage de la synthèse d'une enzyme indispensable) entraîne une augmentation de la libération de GnRH.
Afférences nerveuses aux neurones à GnRH
Les neurones à GnRH sont contrôlés par différentes afférences nerveuses excitatrices ou inhibitrices, directes comme les neurones à GABA ou à glutamate, ou indirectes comme celles qui mettent en jeu la leptine. La compréhension du mécanisme d'action de la leptine nécessite la connaissance de la localisation de ses récepteurs. Ils ont été identifiés sur les neurones à POMC et NPY. La pro-opio-mélanocortine (POMC) est un précurseur de diverses molécules (endorphine, ACTH...) qui jouent, avec le neuropeptide Y (NPY), un rôle fondamental dans la régulation de l'appétit et de la fonction gonadotrope. L'élévation de leur taux entraîne une augmentation du stockage des lipides dans les adipocytes et une élévation de la leptine. Quand la masse adipeuse est normale, un taux élevé de leptine entraîne une inhibition de la synthèse de NPY et une activation des neurones à POMC. Il y a stimulation des neurones à GnRH.
Si la masse adipeuse est inadéquate et le taux de leptine faible, le taux de NPY s'élève et inhibe la sécrétion de GnRH. Ceci explique les retards pubertaires par malnutrition ou encore les aménorrhées par excès d'exercice physique.
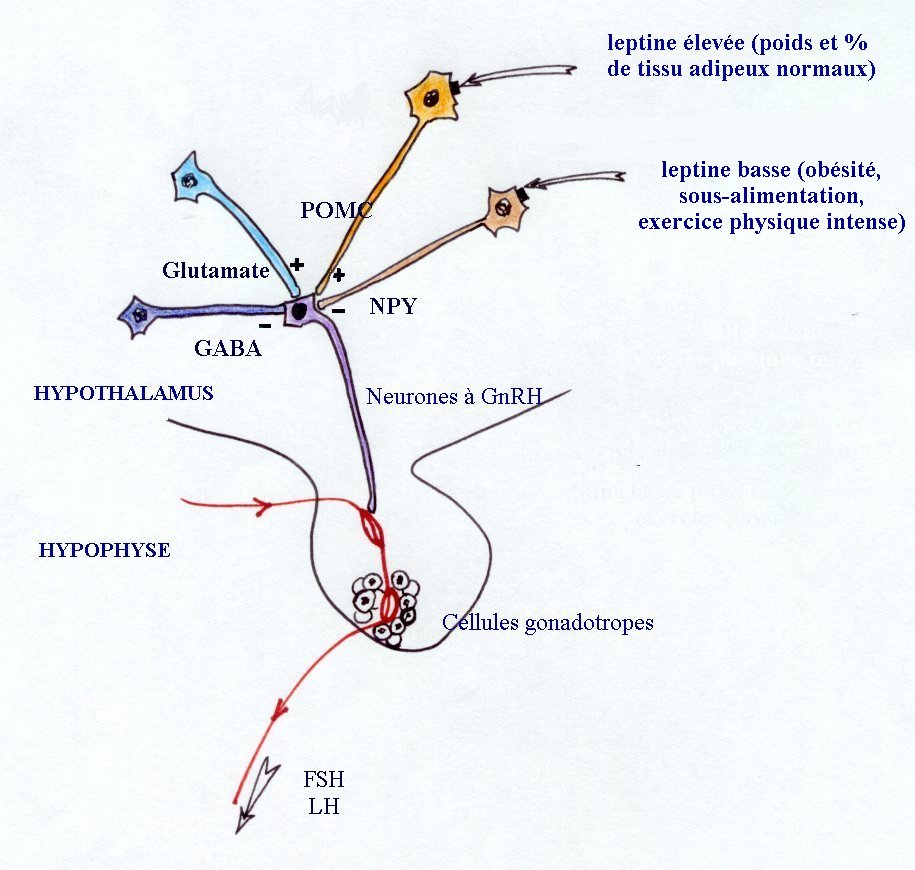 |
|
Schéma récapitulant différentes influences auxquelles sont soumis les neurones à GnRH, et impliquées dans le démarrage pubertaire. Les neurones à GnRH (violet) reçoivent des influences directes des neurones à GABA (en bleu) ou à glutamate (en ciel), et indirecte de la leptine, par l'intermédiaire des neurones à POMC (en jaune) ou à NPY (en marron), sur lesquels elle se fixe par ses récepteurs (carrés noirs). |
Pour conclure, en l'état actuel des connaissances, on peut dire que le processus central du démarrage pubertaire est dominé par l'activation des neurones à GnRH (noyau arqué de l'hypothalamus médio-basal) dont la sécrétion est pulsatile. L'activation du générateur de pulses est réprimée jusqu'à la puberté par des facteurs tels que l'insuffisance de développement somatique. Ces facteurs exercent leur influence sur ces neurones par l'intermédiare d'hormones comme la leptine, ou de neuromédiateurs comme le NPY, le glutamate ou le GABA. Mais les mécanismes intimes du déclenchement de la puberté ne sont pas encore totalement connus.