Les spectres d'absorption
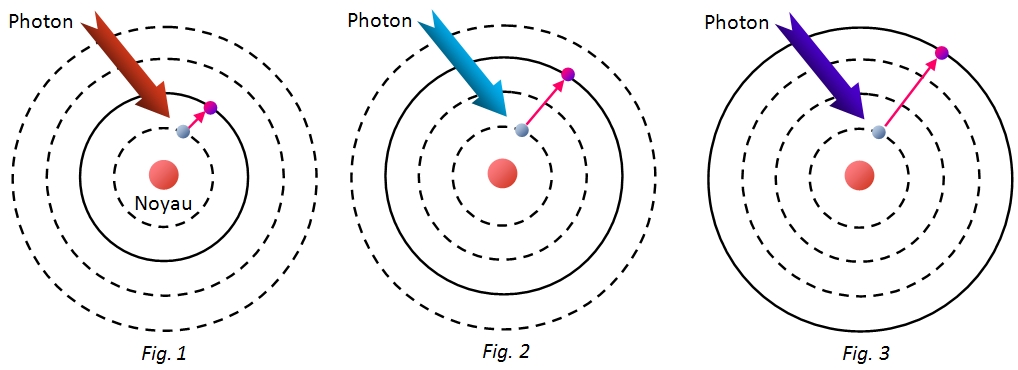
Rappelons que la lumière blanche est constituée d'une infinité de radiations monochromatiques. Considérons l'un des photons qui traverse le gaz (par exemple un photon rouge). Il dispose exactement de la quantité d'énergie nécessaire pour que l'électron de l'atome d'hydrogène passe à un niveau d'énergie supérieur (fig.1). Ce photon ne sera plus donc présent dans la lumière transmise : le spectre présentera alors une raie noire. Un photon bleu qui dispose de plus d'énergie que le photon rouge fera passer l'électron à un niveau d'énergie encore plus grand (fig.2). Idem pour le photon indigo qui est encore plus énergétique. Seul l'atome d'hydrogène pourra absorber simultanément ces photons : son spectre d'absorption constitue donc là encore une signature qui lui est propre.
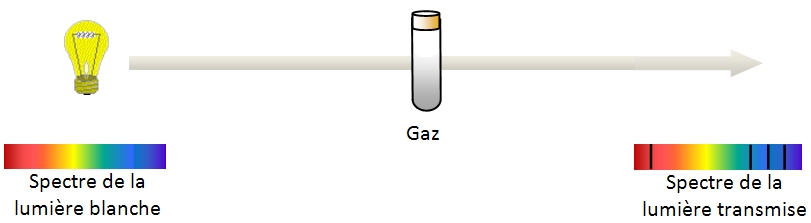
On remarque que ce spectre comporte des raies noires dont les longueurs d'ondes sont identiques à celles présentes dans le spectre d'émission du même gaz.

Une entité chimique (atome, ion, molécule) ne peut absorber que les radiations qu'elle est capable d'émettre.
- Que nous apprend un spectre d'absorption ?
En analysant les ondes électromagnétiques reçues par la Terre, et en mettant en évidence une absorption de certaines longueurs d'ondes, on peut identifier la présence d'une entité chimique dans la région de l’espace étudiée. Pour ce faire, on utilise un spectroscope ou un capteur CCD pour enregistrer des spectres d'absorption. On peut alors déterminer les longueurs d’onde manquantes et en déduire la nature des atomes, des ions ou des molécules responsables de leur absorption.

