Les plaques amyloïdes
L’amyloïdogenèse = la formation des plaques séniles
Composition de la plaque amyloïde
Les plaques amyloïdes sont constituées de l’agrégation de peptides amyloïdes béta. (peptide « Aß »).
Le peptide Aß est un peptide de 42 acides aminés environ (39 à 43) qui n’est normalement pas présent dans le cerveau : il provient d’un mauvais clivage de la protéine APP (Amyloïd Protein Precursor).
| A l'échelle de la microscopie optique | les plaques séniles apparaissent comme des masses sphériques, d'un diamètre de 5 à 100 micromètres, constituées par un dépôt de substance amyloïde plus ou moins dense. |
| A l'échelle de la microscopie électronique | la substance amyloïde est formée de faisceaux de filaments droits d'un diamètre de 6 à 9 nanomètres qui occupent le domaine extra-cellulaire du tissu nerveux central. |
| A l'échelle moléculaire | nous savons depuis les travaux de Glenner en 1984 que le constituant de base de la substance amyloïde des plaques séniles et de l'angiopathie amyloïde est un polypeptide d'une quarantaine d'acides aminés dénommé "peptide Aß". |
Remarques microscopiques:
Le terme "amyloïd" fait référence à un groupe de dépôts de diverses protéines extracellulaires, présents dans diverses maladies. Ces protéines se colorent en bleu avec l'iode, tout comme l'amidon, ce qui explique leur nom (amyloïde = qui ressemble à l'amidon). Ces dépôts sont retrouvés dans la totalité du cortex cérébral au cours de la maladie d'Alzheimer et de la Trisomie 21. On peut les retrouver également dans les noyaux sous-corticaux, le cervelet et dans la paroi de certains vaisseaux corticaux et méningés (constituant ainsi ce que l'on appelle une angiopathie amyloïde).
Remarques moléculaires:
La conformation moléculaire particulière du peptide est de type "structure ß" qui lui confère un caractère très insoluble et très stable à la protéine. Le peptide a une longueur hétérogène, variant de 39 à 43 résidus d'acides aminés. Il existe deux formes principales: les formes 1-40 et 1-42.
Structure et localisation de la plaque amyloïde
Les plaques amyloïdes apparaissent comme des masses sphériques d’un diamètre de 5 à 100 micromètres. Elles sont composées :
- Au centre : de peptides Aß qui s’agrègent entre eux (du fait de leur structure et leur insolubilité) et forment des faisceaux de filaments droits d’un diamètre de 6 à 9 nanomètres. Ce cœur amyloïde est aussi en contact avec des cellules microgliales responsables d’une réaction inflammatoire modérée.
- En périphérie : des prolongements nerveux (surtout axones) qui s’enroulent autour du cœur interne.
Ces plaques ont une localisation extracellulaire. Elles apparaissent d’abord dans les cortex préfrontal et temporaux, et envahissent rapidement le néocortex, puis atteignent les noyaux sous corticaux, le tronc cérébral et le cervelet.
| Coloration des plaques amyloïdes à la thioflavine | 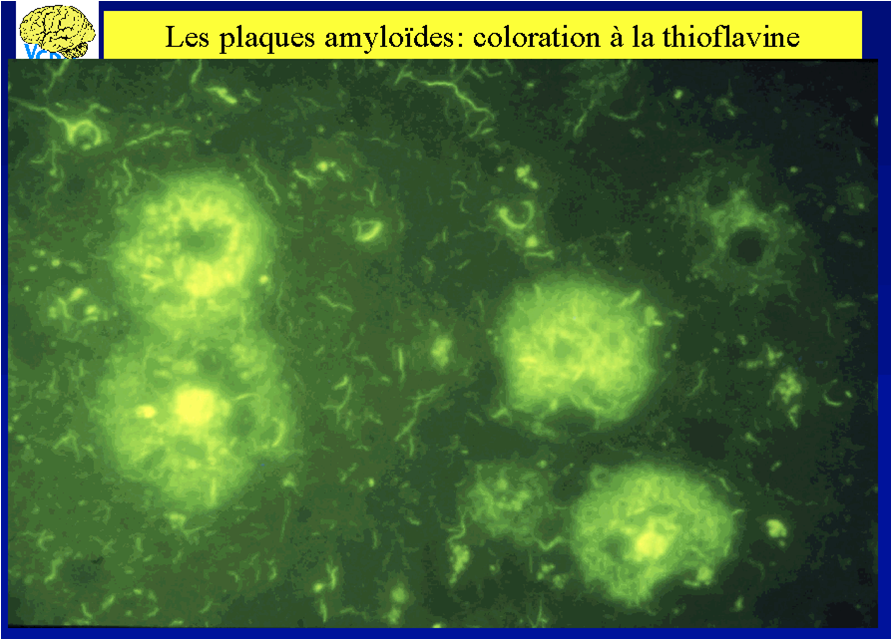 |
|
Autre mode de coloration des plaques amyloïdes
|
|
| Localisation et schématisation des plaques amyloïdes | |
Télécharger la schématisation de plaques amyloïdes (pptx)
Le polypeptide Aß pdérive de la dégradation de la protéine APP (Amyloïd Protein Precursor) de 770 acides aminés, codée par un seul gène situé sur le chromosome 21. Suite à un épissage alternatif, le gène de l'APP donne plusieurs ARNm, l'APP se présente sous 3 formes majeures, en fonction du nombre d'acides aminés:
- APP 695 (forme majoritaire du cerveau jeune et non pathologique qui s'insère dans la membrane cytoplasmique au niveau du segment constitué par la substance Ab),
- APP 751 (nexine 2), avec un KPI (inhibiteur de protéase de type Kunitz)
- APP 770 (présentes chez les trisomiques et dans les cas de MA familiale et précoce).
Que connait-on de cette protéine?
La protéine APP est une protéine transmembranaire qui semble jouer plusieurs rôles
- récepteur de surface,
- molécule d'interaction entre les cellules,
- intervient dans la formation du cytosquelette,
- dans la régulation de la concentration de Ca2+ intracellulaire
- dans la formation des synapses,
- dans la plasticité neuronale et la neurotransmission en particulier pour le système cholinergique,
- Elle est également sécrétée pour protéger le neurone contre le stress oxydatif et possède une partie intracellulaire qui interagirait avec les protéines Tau .
On a découvert en 1999 que les enzymes responsables de la coupure de l'APP en peptide amyloïde b (ou Ab) étaient des sécrétases, qui agissent sur la partie transmembranaire de l'APP.
On constate que dans un cerveau non-malade, l'APP est coupée presque exclusivement par la sécrétase a, qui donne ainsi naissance à un peptide Ab qui est soluble et qui donc ne donnera pas de plaques amyloïdes.
Par contre, chez les malades, on constate que la sécrétase a n'est plus la seule à agir (soit parce qu'elle est débordée car il y a augmentation de la synthèse d'APP ou bien diminution de sa synthèse) et qu'interviennent également les sécrétases b et g, qui donnent naissance au polypeptide de 39 à 43 acides aminés appelé amyloïde b, qui est insoluble de part ses feuillets b et qui va s'agglomérer pour former les plaques séniles.
|
Schématisation du métabolisme de l’AbPP et la génération des peptides Ab. La voie non-amyloidogénique est initiée par le clivage d’une a-secrétase dans le domaine cytosolique de l’AbPP. Ensuite, la g-secrétase clive dans le domaine transmembranaire du fragment résiduel (C83) pour générer les peptides P3 et AICD. La voie amyloidogénique, quant à elle, est initiée par la b-secrétase qui clive elle aussi (mais à un endroit différent) la partie cytosolique de l’AbPP. Ensuite, l’action de la g-secrétase libère les peptides Ab (et l’AICD) du fragment C99. |
Conséquences de la plaque amyloïde :
L’accumulation du peptide A bêta dans le milieu extracellulaire entraînerait des altérations des membranes cellulaires avec entrée massive du calcium dans la cellule et entraînerait une réaction inflammatoire. Ces lésions entraîneraient la mort neuronale. Cependant , alors que la densité et la localisation des dégénérescences neurofibrillaires sont corrélées aux symptômes, et notamment à la démence, ce n’est pas le cas des plaques amyloïdes. D’ailleurs, on observe souvent de nombreux dépôts de peptides A bêta chez des personnes agées considérées comme intellectuellement normales. La dégénérescence neuronale serait davantage liée à la perte de la fonction protectrice de l’APP qu’à l’action toxique du peptide A bêta agrégé.
L’apolipoprotéine E (ApoE) : facteur semblant favoriser la formation des fibres amyloïdes
Dans la plaque amyloïde, plusieurs constituants mineurs ont été identifiés dont l’apolipoprotéine E. L'apolipoprotéine E est une protéine qui permet la réparation des neurones, en transportant les lipides nécessaire. L'apolipoprotéine E (ApoE) se fixe fortement au peptide amyloïde Aß, ce qui semble favoriser la formation des fibres amyloïdes. De ce fait, l'apoE peut être considérée comme un co-facteur de l'amyloïdogénèse. La mort des neurones a été très discutée et serait tardive, elle n’est pas spécifique de la maladie d’Alzheimer et serait sans doute une conséquence à long terme du dysfonctionnement des neurones lésées.
L'APP non pathogène (APP 695)
Les enzymes responsables de la coupure de l'APP en peptide amyloïde bêta sont des protéinases qui clivent l'APP, dont les mieux étudiées sont les sécrétases.
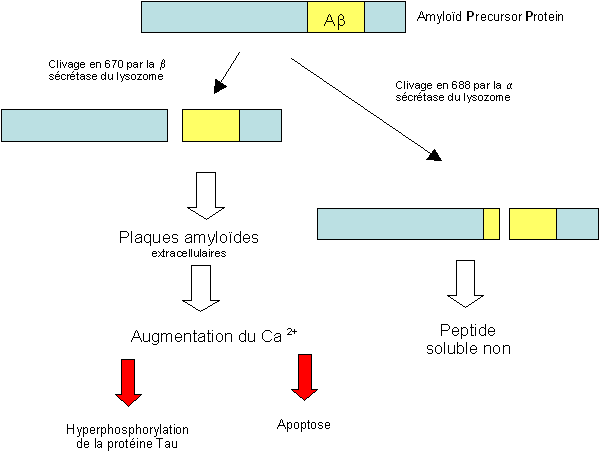
Les sécrétases produisent un fragment peptidique soluble renfermant seulement une partie du peptide pathogène Ab.
Dans un cerveau non malade, l'APP est coupée presque exclusivement par la sécrétase a (à un niveau voisin du segment de la bêta amyloïde): cette coupure protéique donne naissance à un peptide qui est soluble et qui donc ne donnera pas de plaques amyloïdes. Dans les conditions physiologiques, il n'y a pas formation de la bêta amyloïde libre.
L'APP est sécrétée dans le milieu extracellulaire par la plupart des cellules et ses rôles sont multiples :
- Une séquence d'amino-acides de l'APP se lie avec l'héparine et les héparines sulfates protéoglycanes.
- Une liaison du même type s'effectue avec la matrice extracellulaire et permet la régulation de la croissance, de la différenciation cellulaire et la modulation de l'adhésion entre les cellules.
- Rôle dans la formation du cytosquelette et dans la formation des synapses tout comme dans la plasticité neuronale et la neurotransmission en particulier pour le système cholinergique
- Elle est également sécrétée pour protéger le neurone contre le stress oxydatif
- Elle possède une partie intracellulaire qui interagirait avec les protéines Tau.
Sources
http://www.alzheimer-adna.com/Alz_/Alzheimer.sommaire.html
http://membres.lycos.fr/hippolinae/alzheimer.htm#II1a1
http://membres.lycos.fr/hippolinae/alzheimer.htm
http://fr.wikipedia.org/wiki/Alzheimer
http://www.alzheimer-adna.com/Alz_/Alzheimer.sommaire.html
Cerveau et Psycho : n°26 – bimestriel mars- avril 2008 : article « le cerveau malade à la loupe » de Charles DUYCKAERTS p 60-65
http://archimede.bibl.ulaval.ca/archimede/files/195b156b-7d7c-4bf9-b984-8878836cb3c3/ch01.html#d0e161

