Acétyl-choline et développement du motoneurone
ROLE DE L’ACETYLCHOLINE DANS LE DEVELOPPEMENT EMBRYONNAIRE DU MOTONEURONE SPINAL
Ecrit par Jean-Pierre Ternaux (CNRS, GERM, Marseille, 2003)
Dans la moelle épinière du fœtus de rat, dès le jour embryonnaire E12 (gestation de 21 jours), alors que le tube neural n'est pas encore refermé, les motoneurones spinaux présentent une immunoréactivité à des anticorps dirigés contre l'acétylcholine et son enzyme de synthèse la Choline Acétyl tansférase (ChAT).
Les dosages en chimiluminescence sur des motoneurones purifiés par gradient de densité, montrent également la présence d'acétylcholine dans les motoneurones et la libération de cette molécule dans l'espace extracellulaire.
A ce stade, aucune jonction neuro-musculaire n'est établie, au niveau des fibres musculaires cibles, suggérant que l'acétylcholine ne soit pas impliquée dans les mécanismes de neurotransmission.
1. ACETYLCHOLINE ET MORPHOGENESE
L'implication de l'acétylcholine dans l'acquisition des propriétés morpho-fonctionnelles des motoneurones spinaux au cours du développement embryonnaire est étayée par un ensemble de résultats obtenus sur des préparations de motoneurones embryonnaires maintenus in vitro ou en culture.
L'addition d'acétylcholine dans des cultures de motoneurones spinaux purifiés (milieu de culture défini) n'entraîne pas de modifications significatives des paramètres morphologiques au cours du développement in vitro.
Cette absence d'effet est liée à la présence d'acétylcholine-estérase au niveau de la membrane du motoneurone et à la libération de cette enzyme dans le milieu extracellulaire.
Ainsi, les concentrations d'acétylcholine (ACh) dans le milieu extracellulaire résultent de la balance entre les quantités libérées par les motoneurones et celles hydrolysées par son enzyme de dégradation (l'AChE) .
L'addition d'un analogue de l'acétylcholine dans le milieu de culture, comme le carbachol, non dégradé par l'AChE, entraîne une réduction significative de la longueur totale des neurites et en particulier de celle des axones des motoneurones.
Cette observation suggère que l'ACh module l'élongation neuritique.
Compte tenu que les effets du carbachol, antagoniste mixte de l'ACh, s'exercent au travers de récepteurs nicotiniques et muscariniques, il est impossible, dans ces conditions expérimentales, d'attribuer l'effet inhibiteur de l'ACh à la mise en jeu de l'un ou l'autre de ces récepteurs.
L'addition de nicotine (agoniste cholinergique) dans le milieu de culture provoque des effets similaires à ceux détectés avec du carbachol, suggérant une implication des autorécepteurs nicotiniques, présents à la membrane du motoneurone embryonnaire.
L'inhibition de l'activité de l'AChE par différentes substances inhibitrices du site catalytique de l'enzyme (Ecothiopate, BW 284C51), qui entraînent une augmentation significative des taux extracellulaires d'ACh, induit une inhibition modérée de la longueur des neurites émergeants du soma des motoneurones.
Les effets observés avec un inhibiteur du site périphérique de l'AChE, comme la fasciculine II qui bloque la pénétration de l'ACh dans la gorge catalytique de l'AChE, sont une diminution significative de la longueur des prolongements dendritiques et du nombre de branchements, alors que la longueur de l'axone est significativement augmentée.
 |
 |
| Modèle de liaison de l'acétyl-choline (ACh) à son enzyme de dégradation, l'acétyl-choline -estérase (AChe). | Effets de la fasciculine sur la morphologie du motoneurone en développement. |
 Modèle de liaison de la fasciculine II à l'enzyme acétyl-choline-estérase (AChe). |
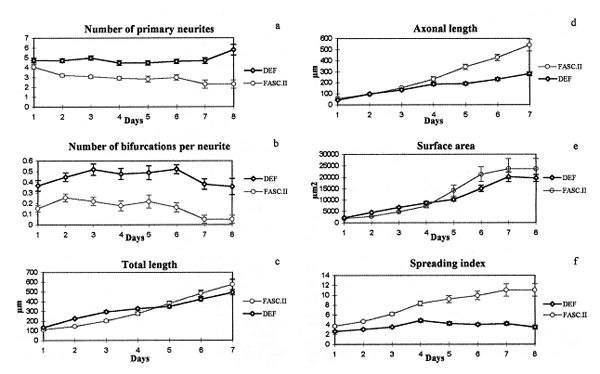 |
| Etude de l'influence de la fasciculine sur la morphologie du motoneurone en développement. Nombre de neurites primaires, longueur de l'axone, nombre de ramifications par neurite, surface du neurone, longueur totale et index d'étirement (IE = 3.1416 X d2 /4S) en présence (FASCII) ou en absence (DEF) de fasciculine |
L'ensemble de ces résultats montre que des variations des taux extracellulaires d'ACh modulent la morphogenèse des motoneurones au cours du développement embryonnaire. La libération d’ACh par le motoneurone embryonnaire induit autour du soma la formation d’un gradient de concentration.
Les hautes concentrations d’ACh présentes à proximité de la membrane exercent une inhibition sur l’initiation neuritique. Malgré cela, des protusions membranaires résultant d’instabilité au niveau de la membrane et impliquant une réorganisation des molécules du cytosquelette sous-jacent sont capables de franchir les régions du gradient possédant les plus fortes concentrations en ACh.
Dans ces conditions les neurites émergeants du soma ne sont plus soumis à l’inhibition cholinergique et la vitesse d’élongation est alors significativement augmentée. Le modèle d’élongation ci-dessous est particulièrement représentatif des phénomènes observés au niveau de la pousse de l’axone.
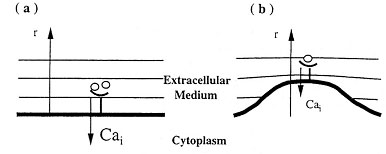 |
| Légendes: - le trait épais représente la membrane du neurone; lisse en a, celle-ci présente une protusion en b, - un ligand fixé à son récepteur ainsi que l'entrée de calcium qui en résulte sont également figurés, - la flêche vers le haut indique un gradient de concentration en ACh, décroissant selon l'éloignement (distance "r") vis à vis du neurone. D’après Bataillé et al., European Journal of Neuroscience, 1998 et Limozin et al., Neuroreport, 1997. |
2. L'ACETYLCHOLINE: UN FACTEUR TROPHIQUE
Comme nous l’avons observé précédemment, les effets de l’ACh sur la maturation et la différenciation du motoneurone, impliquent la mise en jeu d’autorécepteurs nicotiniques qui sont présents, dès les stades précoces du développement, sur la membrane des motoneurones embryonnaires.
Ces derniers peuvent être mis en évidence par des marquages immunocytologiques utilisant des anticorps spécifiques dirigés contre la protéine réceptrice.
Chez le vertébré adulte, les récepteurs nicotiniques sont constitués de cinq sous–unités (2α, 1β, 1γ, 1δ) rassemblées autour d’un canal ionique central perméable aux ions calcium.
Au cours du développement, l’expression et l’assemblage des sous unités sont différents et la sous unité α7 est prépondérante dans de nombreuses régions du système nerveux. Cette expression s’éteint rapidement après la naissance.
La sous unité α7 du récepteur nicotinique est présente à la membrane des motoneurones embryonnaires. Sa présence peut être mise en évidence à la fois avec des anticorps spécifiques dirigés contre cette protéine ou en utilisant des substances pharmacologiques couplées à un fluorophore, comme l'α bungarotoxine couplée à la rhodamine, qui se lie spécifiquement au récepteur nicotinique.
Dans des cultures de motoneurones purifiés à partir de moelle épinière embryonnaire de rat et maintenus dans un milieu défini, il est possible de bloquer l’expression de la sous-unité α7 en utilisant un oligonucléotide antisens.
Dans ces conditions, après pénétration de l’oligonucléotide antisens dans le cytoplasme des motoneurones embryonnaires, l’expression de la sous-unité α7 à la membrane du motoneurone est significativement réduite.
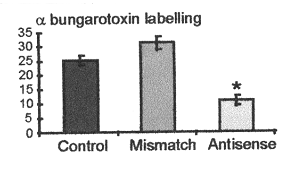
Cette diminution est attestée à la fois par une diminution du marquage immunocytologique avec un anticorps spécifique dirigé contre la sous-unité α7 ou par une baisse significative du marquage observé avec l’α bungarotoxine.
Les résultats obtenus dans les cultures traitées avec l’oligonucléotide antisens sont comparés à des cultures contrôles ou à des cultures traitées avec un oligonucléotide “ missmatch ” (différent très légèrement de l'oligonucléotide anti-sens) qui ne bloque pas l'expression d’α7.
La diminution de l’expression du récepteur nicotinique à la membrane des motoneurones spinaux embryonnaires induit des modifications morphologiques qui se traduisent essentiellement par une augmentation significative de la longueur des axones.
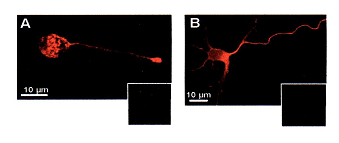
Marquage des recepteurs nocotinique à l'ACh d'un neurone par l'α bungarotoxine couplée à la rhodamine:
- en A après perméabilisation membranaire: la coloration du cytoplasme atteste d'une synthèse intra-cytoplasmique du récepteur et de sa présence dans le bouton synaptique
- en B sans perméabilisation membranaire, et à plus faible grossissement, le recepteur est mis en évidence sur toute la srface du neurone
- les cadres sombres correspondent à des préparation similaire témoins, avec la rhodamine (fluorochrome) mais sans l'α bungarotoxine Evaluation du marquage à l'α bungarotoxine (représentant l'expression du recepteur nicotinque à l'ACh) selon la présence :
- d'aucun oligonucléotide (témoin)
- d'un oligonucléotide anti-sens
- ou de son mismatch (oligonucléotide anti-sens modifié)
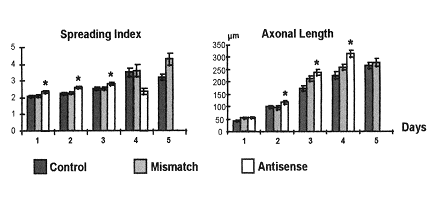
Index d'étirement et longueur de l'axone selon l'expression du récepteur nicotinique à l'ACH, déterminée par la présence :
- d'aucun oligonucléotide (témoin)
- d'un oligonucléotide anti-sens
- ou de son mismatch (oligonucléotide anti-sens modifié)
Ce résultat montre clairement que les effets inhibiteurs de l’ACh sur l’élongation neuritique résultent de la liaison de la molécule à son récepteur nicotinique. La non expression de la sous unité α7 induit une augmentation de la longueur de l’axone.
Outre cet effet morphogène, la non expression de la sous unité α7 du récepteur nicotinique s’accompagne d’une diminution significative de la survie des motoneurones.
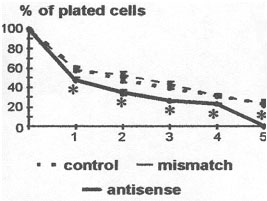 |
| Nombre de cellules dans le fond de la boîte de culture, en fonction de la présence : - d'aucun oligonucléotide (témoin) - d'un oligonucléotide anti-sens - ou de son mismatch (oligonucléotide anti-sens modifié) D’après Catone et Ternaux, J. Neurobiol., 2003. |
Après cinq jours de culture, la quasi-totalité des motoneurones cultivés en présence de l’oligonucléotide antisens dégénèrent alors qu’un pourcentage relativement important de motoneurones (25 à 30%) sont encore vivants dans les cultures contrôles ou traitées avec l’oligonucléotide missmatch. En absence d’expression de la sous-unité α7, les motoneurones ont mis en place rapidement le programme de mort cellulaire et exhibent des figures d’apoptose.
Ce résultat montre qu’en dehors des effets de l’ACh sur la morphogenèse, la molécule d’ACh exerce également un effet trophique sur les motoneurones embryonnaires. Cet effet trophique est médié via la sous-unité a7 du récepteur nicotinique qui est spécifiquement exprimée au cours de la période prénatale.
3. L’ACETYLCHOLINE: UN FACTEUR CHEMOTRACTANT.
Les travaux de Zheng et al, (Nature,1994) montrent que l’acétylcholine est un facteur chémotractant de l’axone des motoneurones. Ces auteurs utilisent des motoneurones spinaux embryonnaires de xénope et observent la pousse de leurs neurites dans des différentes conditions.
Les motoneurones sont placés dans un milieu de culture et des images successives sont réalisées toutes les minutes à l’aide d’un système photographique de type “ time lapse ”. Dans ces conditions il est possible de tracer la trajectoire des neurites lors de leur élongation.
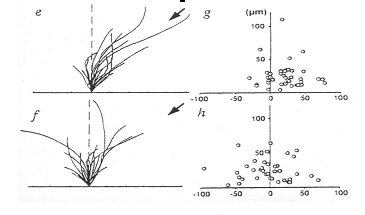 |
Les pointes de flêches indiquent la position de la microélectrode libérant de l'acétyl-choline. Le croquis "e" représente la forme des motoneurones, les cercles "g" indiquent la position de l'extrêmité de chacun d'eux. On note que les neurones croissent préférentiellement en direction de la microélectrode. Les données "f" et "h" sont identiques au document "e" et "g", à part la présence dans le milieu d'un antagoniste du récepteur niocotinique: la d- tubocurarine. On note dans ce cas que la croissance des neurones ne présente aucune direction préférentielle. D'après Zheng et al, Nature, 1994. |
Dans l'expérience ci-dessus, une microéléctrode contenant de l’ACh dont la pointe est suffisamment large pour laisser échapper la solution d’ACh est placée à une distance d’environ 250 µm du corps cellulaire d’un motoneurone. Dans ces conditions, un gradient d’ACh est créé à la pointe de la microélectrode.
L’observation des neurites, au bout d’une heure, montre que toutes les neurites émergeant du corps cellulaire se sont développées vers la pointe de la microélectrode, c’est à dire vers les concentrations les plus élevées en ACh.
L’effet chémotractant de l’ACh observé dans ces conditions expérimentales est aboli par l’addition dans le milieu de culture d’un antagoniste des récepteurs nicotiniques comme la d-tubocurarine.
Dans ces conditions les neurites émergeant du soma poussent dans les différentes directions, ignorant le gradient d’acétylcholine.
Au niveau des cônes de croissance des neurites l’effet chémotractant de l’ACh, via le récepteur nicotinique s’accompagne de variations locales des concentrations de calcium intracellulaires.
Ces modifications des concentrations de calcium au niveau du cône de croissance sont responsables des réarrangements moléculaires au niveau des différentes protéines du cytosquelette (tubuline, actine, et micotubules Associated Proteins : MAPs) permettant une adaptation de ces dernières aux contraintes mécaniques liées à l’orientation des neurites vers les plus hautes concentrations en ACh.
Les propriétés chémotractantes de l’ACh sont impliquées dans les processus de guidage de l’axone des motoneurones vers les fibres musculaires.
Ainsi l’ACh présente dans le milieu extracellulaire joue un rôle important dans la mise en place des jonctions neuromusculaires.
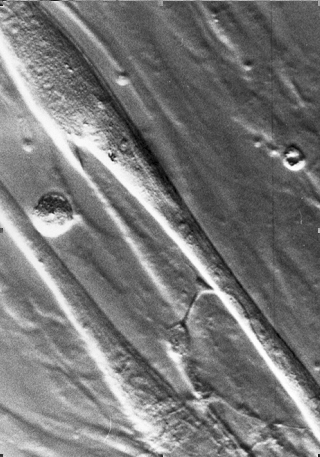 |
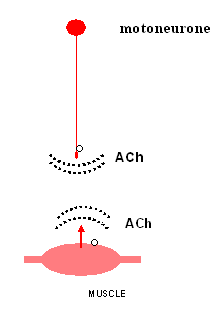 Schéma représentant les gradients d'acétyl-choline produits par le neurone et par le myoblaste, l'ensemble de ces gradients déterminant la mise en place des jonctions neuro-musculaires (cercle = recepteur nicotinque à l'ACh). D’après Hamann et al., Journal of Physiology, London, 1995. |
| Microscope à contraste de phase: deux myoblastes sont visibles ainsi que l'extremité d'un axone formant jonction neuro-musculaire avec le myoblaste (centre bas de la photo) |
Au cours du développement embryonnaire des myoblastes, l’ACh est synthétisée et libérée par les myoblates embryonnaires. La molécule joue un rôle primordial dans la multiplication et la fusion des myoblastes en fibres musculaires.
Ainsi, un gradient d’ACh est formé autour des fibres musculaires embryonnaires, guidant les axones des motoneurones vers les futures jonctions neuro-musculaires.
