3. Le contrôle hormonal du sexe
LE CONTROLE HORMONAL DE LA DIFFERENCIATION DU SEXE
Lien vers le document original
Rédigée par Françoise Jauzein, Lycée Berthollet, Annecy
Relue par Solange Magre, Université Paris 6 et Bernard Vigier, INRA
L'influence de l'environnement hormonal pendant le développement embryonnaire sur l'anatomie sexuelle de l'animal est connu depuis fort longtemps; la présence, dans l'utérus gravide, d'embryons mâles à proximité d'un embryon femelle entraîne une masculinisation des voies génitales de l'embryon femelle. Chez les bovins, on appelle" free-martinisme" le phénomène qui aboutit à la naissance d'une génisse stérile à cause d'échanges sanguins avec un jumeau mâle lors du développement in utéro.
Ce sont les travaux d'Alfred Jost (1950) qui ont permis d'établir clairement que, chez tous les mammifères, l'appareil génital se différencie dans le sens mâle sous l'influence des hormones secrétées par le testicule foetal, alors qu'il se différencie spontanément dans le sens femelle en l'absence de gonades mâles ou femelles: des foetus de lapin des deux sexes, castrés in utéro, à un stade où la gonade est différenciée mais pas les voies génitales, et laissés dans l'utérus, acquièrent une conformation féminine. On dit que le sexe femelle est le sexe constitutif ou sexe "par défaut".
Le testicule et la différenciation sexuelle
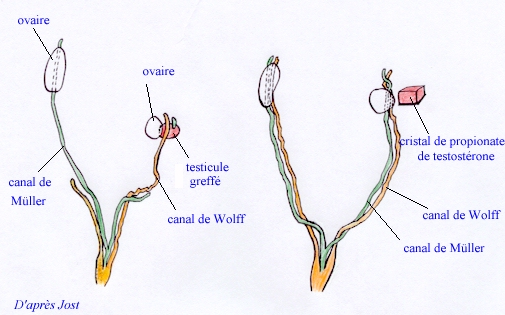
Les expériences de greffe de testicule chez le lapin ont clairement montré que les secrétions hormonales du testicule greffé sur une femelle entraînaient à la fois le développement des canaux de Wolff et la disparition des canaux de Müller.
Cependant, le remplacement du testicule greffé par un cristal de propionate de testostérone n'entraîne qu'une partie des effets précédemment observés.
De plus, l'utilisation d'un anti-androgène (acétate de cyproteron), sur des lapines gestantes, empêche la masculinisation des foetus mâles mais n'empêche pas la régression des canaux de Müller.
|
|
|
Modification des voies génitales de deux foetus de lapin femelle de 28 jours A gauche, femelle sur laquelle on a greffé, à l'âge de 20 jours, un testicule d'un mâle du même âge. Le canal de Wolff se développe du côté du greffon et le canal de Müller régresse, du même côté. |
Le testicule foetal exerce donc deux sortes d'action pendant la différenciation de l'appareil génital, d'une part, il provoque la disparition des canaux de Müller, d'autre part, il est responsable du développement des voies mâles et la masculinisation du sinus urogénital et des organes génitaux externes. Les expériences précédentes prouvent que ces actions sont contrôlées par deux substances différentes, dont une est la testostérone et l'autre un "facteur anti-Müllérien".
Les sécrétions testiculaires
Deux types cellulaires produisent des hormones dans le testicule.
|
|
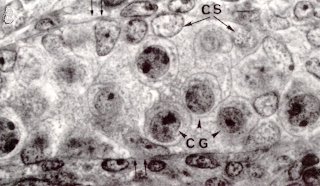
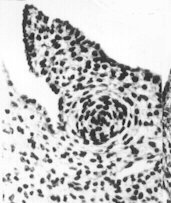
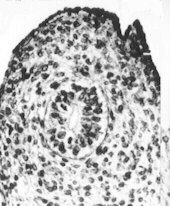
Coupe de testicule de foetus de rat de 14 jours observé au MET On reconnaît au centre, la section d'un cordon séminifère, futur tube séminifère (l'enveloppe du cordon est pointée d'une double flêche) renfermant des cellules de Sertoli (CS, à noyau clair) et des cellules germinales (CG, à noyau plus dense). Les cellules de Leydig, extérieures à ces cordons, ne seront reconnaissables qu'à partir de 15,5 jours. (Demande de droits en cours) La reproduction chez les mammifères et chez l'homme. C. Thibaut, Ellipses, INRA. |
Ce sont les cellules de Sertoli primitives, qui, à partir de la septième semaine (chez l'homme) sécrètent le facteur anti-Müllérien appelé initialement "Müllerian inhibitor" puis "Anti-Müllerian Hormone", ou AMH, et encore "Müllerian Inhibiting Substance", ou MIS, aux Etats Unis. C'est une glycoprotéine, dimère, de 140 KD, dont le gène est situé, chez l'homme, sur le chromosome 19. Cette hormone présente une nette homologie de sa partie COOH-terminale avec certains facteurs de croissance comme l'inhibine et, comme eux, doit subir un clivage de cette partie pour être active. Ce clivage a lieu au niveau des cellules cibles, qui doivent donc exprimer l'enzyme nécessaire pour être sensibles.
L'AMH déclenche une réponse biologique de ses cellules cibles par l'intermédiaire de deux récepteurs trans-membranaires: le type II qui lie l'hormone et le type I qui transmet le signal en phosphorylant des protéines cytoplasmiques qui vont ensuite réguler, dans le noyau, l'expression de gène cibles.
Cette hormone provoque une régression rapide des canaux de Müller (on pense actuellement que la disparition des cellules épithéliales de ces canaux se fait plutôt par dédifférenciation en cellules mésenchymateuses que par nécrose).
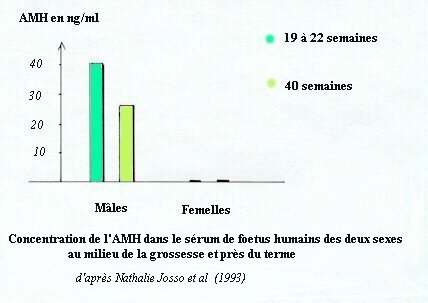
Dans toutes les espèces l'évolution de l'AMH est identique.On en trouve dès les premiers stades de la différenciation du testicule foetal, elle atteint un taux maximal pendant la période de régression des canaux de Müller mais reste à un taux élevé ensuite, pour ne chuter qu'à la puberté.
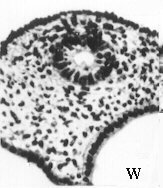
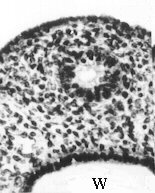
Evolution des canaux de Müller chez des foetus de bovin
mâles et femelles (Jost, Vigier et Prépin, 1972)
|
|
|
|
|
|
|
|
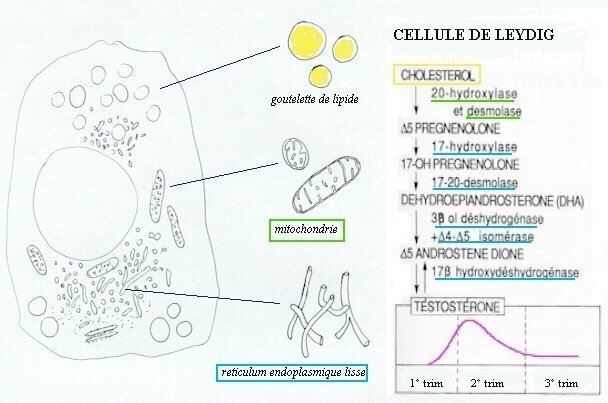
Les cellules de Leydig, extérieures aux cordons séminifères, sécrètent, dès la sixième semaine, des quantités croissantes de testostérone, dont le taux atteint un maximum dans le sang foetal au début du deuxième trimestre, période essentielle de la masculinisation. Cette hormone est produite à partir du cholestérol, selon une chaîne de biosynthèse qui met en jeu sept enzymes.
|
|
| Biosynthèse de la testostérone Le cholestérol ( en C27) stocké dans la cellule stéroidogène sous forme de goutelettes lipidiques, pénètre dans la mitochondrie où se réalise la coupure de sa chaîne latérale (20-hydroxylase et desmolase). La delta-5-prégnénolone (C 21) sort de la mitochondrie et pénètre dans le réticulum endoplasmique où se réalisent les transformations suivantes, aboutissant à la synthèse de testostérone (C 19). |
Le contrôle de cette synthèse est encore mal connu. Toutefois l'apparition, la multiplication et la régression des cellules de Leydig présente un parallélisme net avec la sécrétion d'hormone chorionique gonadotrope (hCG), élevée en fin de premier trimestre de gestation.
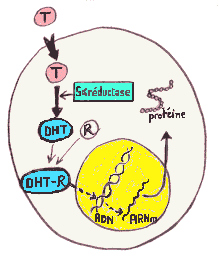
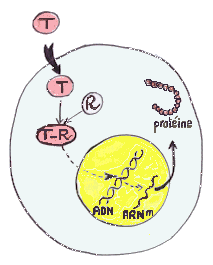
Le mode d'action de la testostérone diffère selon le tissu cible:
|
|
|
|
|
|
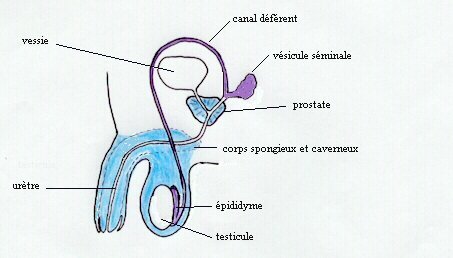
Regions du système génital mâle dont la différenciation dépend de la testostérone (en violet) ou de la dihydrotestostérone (en bleu) |
En plus de la disparition des canaux de Müller sous l'effet de l'AMH et du développement des canaux de Wolff et des organes génitaux externes sous l'effet de la testostérone et de ses dérivés, un troisième phénomène caractérise la différenciation mâle, c'est la descente des testicules dans le scrotum. Chez le mâle, le gubernaculum testis grandit, ce qui permet la descente des gonades alors que chez la femelle ceci ne se produit pas. La croissance du gubernaculum est sous le contrôle d'une hormone récemment découverte, produite uniquement par le testicule foetal, dans les cellules de Leydig, et pas dans l'ovaire. Il s'agit d'un facteur de type insuline: l'insuline-like hormone 3 ou InsL3.
Les anomalies de la différenciation sexuelle sont nombreuses, elles proviennent d'un manque de sécrétion de ces hormones ou du manque de sensibilité de leurs cellules cibles, dû à des récepteurs défectueux.
La différenciation féminine
Elle se réalise plus tardivement. En l'absence de testostérone, les canaux de Wolff commencent à régresser à la dixième semaine et ont disparu à la douzième, les organes génitaux externes se développent dans le sens femelle. En absence d'AMH, les canaux de Müller se maintiennent, et en absence d'InsL3, les gonades restent dans l'abdomen.
Les ovaires du foetus ne sont pas indispensables à la féminisation de l'organisme. De plus, comme la persistance des canaux de Müller et la régression des canaux de Wolff surviennent dans des fragments de tractus génital des deux sexes cultivés in vitro dans un milieu anhormonal, il est clair que la féminisation de ces structures ne provient pas non plus d'oestrogènes d'origine maternelle ou placentaire.
Or chez plusieurs mammifères, on a mis en évidence une production plus ou moins transitoire d'oestrogène par les ébauches ovariennes, bien avant la différenciation des cellules de la thèque ou de la granulosa. Peut-être ces oestrogènes stimulent-ils les ébauches Müllériennes, une fois leur persistance assurée, comme en témoigne le faible développement de ces dérivés chez des foetus de lapin castrés in utéro.