4. Les gènes de détermination sexuelle
LES GENES DE LA DETERMINATION SEXUELLE CHEZ LES MAMMIFERES
Lien vers le document original
Rédigée par Françoise Jauzein, Lycée Berthollet, Annecy
Relue par Corinne Cotinot, INRA
Depuis les travaux de Jost, dans les années 40, on sait que l'ablation des gonades d'un foetus de mammifère sexuellement indifférencié entraîne un développement femelle, aussi bien au niveau du tractus interne que des organes génitaux externes, et ceci, quelque soit son sexe génétique. Ainsi, la détermination du sexe est équivalente à la détermination des testicules.
Le fait que la détermination des testicules dépende de la présence d'un chromosome Y est connu depuis le début des années 60, et a été déduit de l'observation d'anomalies chromosomiques: des humains 45,XO (Turner) ou des souris XO ne montrent pas de développement de tissu testiculaire. De plus, un caryotype humain 47,XXY (Klinefelter) entraîne un phénotype mâle. Ceci prouve que, chez les mammifères, la détermination des testicules dépend de la présence d'un chromosome Y et non du nombre de chromosome X.
Le facteur, encore inconnu, codé par un gène du chromosome Y, et déterminant la différenciation des testicules, a été appelé TDF (testis determining factor).
LE DETERMINANT TESTICULAIRE : SRY
L'identification de TDF a été réalisée en 1989, grâce à l'étude d'individus humains dont le sexe phénotypique est en discordance avec le sexe chromosomique; hommes possédant deux X (46,XX) ou femmes possédant un X et un Y (46,XY).
Ces individus phénotypiquement mâles et porteurs d'un caryotype 46,XX, renfermaient dans leur génôme une séquence provenant du chromosome Y. L'analyse de ce segment d'ADN montra une séquence codante (open-reading frame ou ORF) qui fut appelée: "région déterminant le sexe" du chromosome Y ou SRY (Sex-determining Region of Y chromosome).
Ce gène est situé sur le bras court du chromosome Y humain et répond aux caractéristiques attendues d'un "TDF":
-ce gène est conservé sur le chromosome Y de nombreuses espèces de mammifères;
- la protéine déduite du gène SRY possède un domaine permettant sa liaison à l'ADN. Ce domaine, homologue à celui des protéines du HMG (high mobility group) définit une nouvelle famille de gènes appelé SOX (SRY-related HMG-box) qui interviennent dans de nombreux processus de développement;
-la chronologie de l'expression de ce gène coïncide avec la période de détermination du sexe, il s'exprime chez la souris de 10,5 à 12 jours post coïtum, spécifiquement dans les cellules somatiques de la crête génitale mâle, ce qui correspond aux jours qui précèdent la détermination testiculaire. On trouve des transcrits (ARNm) de ce gène dans le testicule adulte murin et humain;
-des individus qui développent un phénotype femelle malgré la présence d'un Y (46,XY) présentent une mutation dans le gène SRY, le rendant non fonctionnel;
-enfin la meilleure démonstration fut obtenue par transgénèse chez la souris; l'introduction d'un fragment de 14Kb d'ADN contenant le gène Sry (en minuscule = murin), dans une souris femelle XX, entraîne le développement de testicules, ce qui suggère que c'est le seul gène du chromosome Y impliqué dans la détermination testiculaire.
SRY est donc responsable de l'établissement du sexe gonadique, c'est le TDF tant attendu!
Période d'expression et mode d'action de SRY
Chez la souris, la transcription de Sry pendant la vie foetale est limitée à la période de formation des crêtes génitales entre 10,5 et 12,5 jpc (jours post coïtum). Les premières cellules dans lesquelles ce gène s'exprime sont les précurseurs des cellules de Sertoli. Ceci permet, juste avant la formation des cordons séminifères, d'entraîner la différenciation des cellules de soutien vers la voie mâle.
Chez les autres mammifères, dont l'homme, le gène SRY est transcrit pendant une période plus longue dans les cellules de Sertoli, de la formation des crêtes génitales jusqu'après la différenciation de ces cellules. Dans le testicule adulte, ce gène s'exprime dans les cellules germinales méiotiques et post-méiotiques.
|
|
|
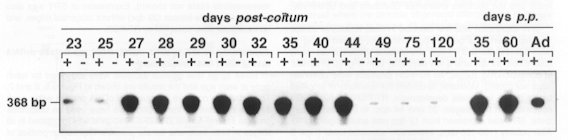
Profil d'expression du gène SRY chez le foetus de mouton (du 23ème au 120ème jour post-coïtum), chez le jeune (35ème et 60ème jour post-partum) puis chez l'adulte, obtenu par autoradiographie des produits RT-PCR. |
La protéine SRY humaine se compose de 204 acides aminés. Elle se lie spécifiquement, par son domaine HMG renfermant environ 80 acides aminés, à l'ADN bicaténaire portant la séquence 5'A/TAACAAA/T 3'. Après fixation de cette protéine, la molécule d'ADN subit une courbure de 70 à 80° dans la direction du grand sillon. Cela pourrait permettre le rapprochement et l'interaction entre des facteurs de transcription fixés sur le ou les gènes cibles de SRY, dont les sites de liaison sont éloignés les uns des autres.
Comme on retrouve la protéine SRY dans le noyau des cellules de Sertoli mais aussi dans les cellules germinales, on peut penser que ce gène permet non seulement la différenciation de la gonade vers la voie mâle mais présente aussi d'autres fonctions.
Ainsi le sexe génétique est déterminé à la fécondation, selon le chromosome sexuel apporté par le spermatozoïde. L'établissement du sexe gonadique est sous contrôle génétique et dépend de la présence du gène SRY.
Suite à l'action du gène SRY, une cascade d'autre gènes est activée dans le testicule. Tandis qu'en l'absence de SRY et en présence de deux chromosomes X, la gonade se différencie en ovaire. Cette période de différenciation gonadique se réalise chez l'homme entre la 5ème et 8ème semaine de gestation.
L'établissement du sexe phénotypique se réalise, quant à lui, sous l'effet des hormones sécrétées par la gonade différenciée, à deux périodes de la vie: le tractus génital se différencie pendant la vie foetale et les caractères sexuels secondaires, à la puberté.
LES AUTRES GENES DE LA CASCADE
|
GENE |
LOCALISATION CHROMOSOMIQUE |
TISSU OU LE GENE S'EXPRIME (souris) |
PERIODE D'EXPRESSION |
CARACTERISTIQUES DE SA PROTEINE |
ROLE DE LA PROTEINE |
| SRY | bras court du chr Y | précurseurs et cellules de Sertoli, cellules germinales mâles | juste avant la différenciation des testicules reprise à l'âge adulte |
204 aa, possède un domaine de liaison à l'ADN entraînant sa courbure |
différenciation de la gonade en testicule |
|
WT1 |
bras long du chr 11 |
crête urogénitale puis |
dès le 9ème jpc et reste exprimé toute la vie dans les gonades |
différentes isoformes protéiques présentant une capacité de liaison à l'ADN (par des domaines en doigt de Zinc) jouant le rôle de facteur d'épissage ou de transcription |
indispensable à la morphogénèse de la cête génitale et régulerait la transcription du gène SRY |
|
SOX9 |
bras long du chr 17 |
crêtes génitales des deux sexes puis cellules de Sertoli |
courte chez la femelle et plus longue chez le mâle |
509 aa, un domaine de liaison à l'ADN |
activation de l'expression du gène de l'AMH |
|
DAX1 |
bras court du chr X |
crêtes génitales et autres tissus |
courte chez les mâles et plus longue chez les femelles |
470 aa, possède une zone de liaison à l'ADN et une zone similaire aux sites de liaison des ligands des récepteurs nucléaires |
inhibition de l'action de SF1 |
|
SF1 |
bras long du chr 9 |
ébauches des gonades des deux sexes et autres tissus |
très précoce dans les deux sexes, se poursuit à l'âge adulte |
récepteur nucléaire |
active l'expression de gènes impliqués dans la stéroïdogénèse |
|
AMH |
bras court du chr 19 |
cellules de Sertoli , cellules de la granulosa |
commence lors de la différenciation testiculaire, est maximale lors de la régression des canaux de Müller et baisse à la puberté |
homologie avec certains facteurs de croissance (TGF-bêta) |
provoque la régression des canaux de Müller et inhibe l'aromatase |
Le gène WT1
Ce gène, localisé sur le bras long du chromosome 11, mesure 50kb et comprend 10 exons. Il code pour différentes isoformes protéiques (selon l'épissage et le processus d'édition de l'ARN), dont un facteur de transcription se liant à l'ADN par des domaines en doigt de Zinc.
Il s'exprime très tôt dans le développement embryonnaire des souris, dès le 9ème jour post-coïtum, au niveau de la crête urogénitale, puis toute la vie dans les gonades, au niveau des cellules de Sertoli du testicule et de la granulosa de l'ovaire.
Il existe différents phénotypes sexuels associés à des mutations du gène WT1. Le syndrome de Denys-Drash qui touche des enfants en bas âge, des deux sexes, associe une insuffisance rénale aigüe, un néphroblastome (tumeur de Wilms, 1/20 000 enfant) et, chez la plupart des individus XY concernés, une dysgénésie gonadique avec ambiguité génitale. Le syndrome de Frasier, lui, se caractérise par une néphropathie à évolution lente et une dysgénésie gonadique qui entraîne, chez les individus XY, un phénotype complètement féminin.
Le gène WT1 semble nécessaire à double dose (deux allèles normaux) pour la détermination du testicule, alors que le développement de l'ovaire peut se faire en présence d'un seul allèle normal.
Chez la souris, l'invalidation du gène WT1 entraîne la mort de l'embryon, qui, ne possédant ni rein ni gonades, présente toujours un phénotype femelle par absence d'hormones mâles.
Ainsi le gène WT1 est impliqué dans la morphogénèse de la crête urogénitale mais aussi dans la différenciation testiculaire.
Comme WT1 et SRY sont tous les deux exprimés dans les cellules de Sertoli, et qu'il existe, sur le promoteur du gène SRY, un site capable de se lier avec une protéine WT1, on suppose que WT1 contrôle directement la transcription de SRY.
Enfin, l'une des isoformes protéiques du gène WT1 est impliquée dans la transcription du gène de l'AMH.
Le gène SOX9
Il appartient à la famille des gènes SOX, puisqu'il code pour une protéine (509 acides aminés) possédant un domaine de fixation à l'ADN de type HMG présentant une forte homologie (71% des aminoacides) avec celui de la protéine SRY. De plus sa protéine possède (dans sa partie C-terminale) un domaine impliqué dans l'activation de la transcription.
L'inactivation du gène SOX9 est responsable d'un syndrome: la dysplasie campomélique. Les personnes atteintes présentent des anomalies osseuses diffuses, et pour les trois-quarts des malades possédant un caryotype 46/XY, des anomalies gonadiques. Ces dernières sont diverses, allant de testicules à des ovaires dysgénésiques avec quelques follicules primordiaux, ce qui constitue donc une inversion sexuelle. Le phénotype externe est alors ambigu ou franchement féminin.
Le gène a été localisé sur le bras long du chromosome 17 humain (17q).
Ce gène s'exprime dans les crêtes génitales des souris des deux sexes. Ensuite, son expression augmente chez le mâle dans les cellules de Sertoli au cours de la différenciation testiculaire tandis qu'elle diminue dans l'ébauche ovarienne de la femelle, confirmant ainsi son implication dans la différenciation gonadique mâle.
Le même dimorphisme de son expression existe chez d'autres mammifères, des oiseaux, des reptiles, ce qui suggère pour ce gène une fonction testiculaire majeure, conservée au cours de l'évolution.
Des expériences in vivo sur des souris transgéniques ont montré que la protéine SOX9 est indispensable à la transcription de l'AMH. Dans les gonades foetales de mammifères, l'expression de l'AMH se produit en effet après celle de SOX9. Cependant dans d'autres taxons (poulet, certains reptiles), elle la précède. Ainsi, la protéine SOX9 ne déclenche pas la lecture du gène de l'AMH mais pourrait être responsable de l'élévation de son expression dans le testicule foetal des vertébrés.
L'étude de patients de caryotype 46/XY, féminisés, porteurs de mutations hétérozygotes de SOX9 ainsi que d'une personne de caryotype 46/XX, masculinisée et porteuse d'une duplication interstitielle du bras long du chromosome 17 a permis d'envisager une intervention de la protéine SOX9 selon sa concentration. Un taux élevé (trois allèles normaux, cas pathologique, ou deux allèles, cas normal) de protéine SOX9 entraînant une masculinisation, par activation de la transcription du gène de l'AMH, alors qu'un taux faible (un seul allèle normal) n'assure pas cette masculinisation.
Le gène DAX1
Dans l'espèce humaine, la duplication d'une région du chromosome X, localisée sur le bras court (Xp), entraîne le développement d'un phénotype féminin, avec dysgénésie gonadique, chez des individus de caryotype 46/XY. Cette région, de 160Kb, a été appelée DSS (Dosage Sensitive Sex-reversal) car elle contient au moins un gène capable, à double dose (deux allèles) d'inhiber la différenciation testiculaire. On a isolé un gène, DAX1, situé dans cette région et codant pour une protéine de 470 acides aminés présentant deux caractéristiques: sa partie C-terminale est similaire aux domaines de liaison du ligand des récepteurs nucléaires et sa partie N-terminale correspond à un nouveau type de domaine capable de se lier à l'ADN.
L'expression de ce gène présente, chez la souris, de grandes similitudes avec celles du gène sf1 ( en minuscules pour le gène murin) et il semble clair que ces deux facteurs soient impliqués dans le contrôle de la fonction de reproduction aux niveaux hypothalamo-hypophysaire et gonadique. Cette expression a été mise en évidence dans les crêtes génitales (et d'autres tissus: surrénales, hypothalamus et hypophyse) de souris des deux sexes, mais, si elle décroît ensuite dans les gonades mâles, elle se maintient chez les femelles, ce qui fait de ce gène un bon candidat à la fonction d'inversion sexuelle décelée dans la zone DSS.
Chez la souris, des lignées transgéniques surexprimant DAX1 (jusqu'à 5 fois la dose normale) ont été créées, et montrent effectivement un effet sur la différenciation testiculaire qui est alors retardée (mais pas empêchée). Chez l'homme des mutations du gène DAX1 sont responsables d'hypogonadotrophie.
Le gène SF1
Ce gène, localisé, chez l'homme, sur le bras long du chromosome 9 (9q), code pour une protéine appelée SF1, pour Stéroidogenic Factor 1.
Cette protéine est un recepteur nucléaire d'un type particulier, régulant la transcription d'un grand nombre de gènes d'enzymes impliquées dans la stéroidogénèse des tissus surrénalien et gonadique. SF1 régule également des gènes d'hormones protéiques hypophysaire (sous-unité bêta de la LH et la FSH) ou testiculaire (AMH en particulier).
Le facteur SF1 est trouvé très précocément au cours du développement de la souris, chez des foetus de 9 jpc (jours post-coïtum), au niveau des ébauches de gonades et ceci, dans les deux sexes. Par la suite les profils d'expression diffèrent selon les espèces.
Le gène de l'AMH
Il est localisé, dans l'espèce humaine, sur le chromosome 19. L'AMH (hormone anti-Müllérienne) présente, dans sa partie C-terminale qui doit être clivée au niveau de la cellule cible pour devenir bio-active, une nette homologie avec certains facteurs de croissance de la famille du TGF-bêta.
|
|
|
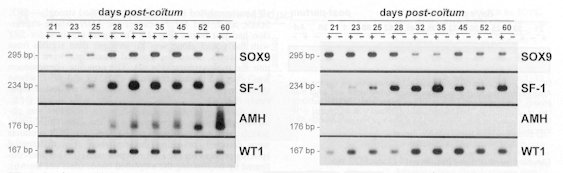
Profils d'expression des gènes SOX9, SF-1, AMH et WT1, Images obtenues par autoradiographie d'une RT-PCR d'ARN de gonades prélevées à différents âges chez des foetus des deux sexes. |
CONTROLE MULTIFACTORIEL DU GENE DE L'AMH
Vu l'influence de l'AMH dans la différenciation somatique, c'est le gène de cette hormone qui, par la régulation de son expression, va être responsable de l'engagement du tractus génital vers une voie mâle ou femelle.
Chez l'homme, le facteur SF1 régule la transcription de l'hormone anti-Müllérienne, mais SF1 n'agit pas seul, il fait partie d'un complexe de plusieurs facteurs de transcription, associant en particulier SOX9 et DAX1. De plus, l'une des isoformes protéiques du gène WT1 agit en synergie avec SF1 pour activer la transcription du gène de l'AMH.
Il a été montré, in vivo, chez la souris, que des mutations dans les sites de fixation des protéines SOX9 et SF1, présents dans le promoteur du gène de l'AMH, entraînaient une modification de son expression. Chez cette espèce, Sox9 contrôle l'initiation de la transcription de ce gène et Sf1 le niveau de transcrits produits.
De plus, par des expériences de liaison protéique, on a montré que les facteurs SOX9 et SF1 (humains) interagissent directement l'un avec l'autre, SOX9 par son domaine de liaison à l'ADN, et SF1 par sa région terminale.
Par ailleurs, des expériences ont prouvé que la protéine DAX1 est un inhibiteur de l'action de SF1 sur ce promoteur.
Ainsi, chez les femelles, un taux élevé de facteur DAX1 (ayant deux chromosomes X, elles possèdent ce gène en deux exemplaires) inhiberait l'action de SF1 sur le promoteur du gène de l'AMH. Ce gène ne serait donc pas transcrit.
A l'inverse, dans la gonade mâle, le taux élevé de facteur SOX9 (gène autosomique) et faible de DAX1 (un seul chromosome X) permettrait l'interaction du complexe de transcription SOX9/SF1 sur le promoteur du gène de l'AMH, assurant ainsi, par la production de cette hormone, une masculinisation des voies génitales.
BILAN DES CONNAISSANCES ACTUELLES
SUR LE DETERMINISME GENETIQUE DU SEXE CHEZ LES MAMMIFERES
|
|
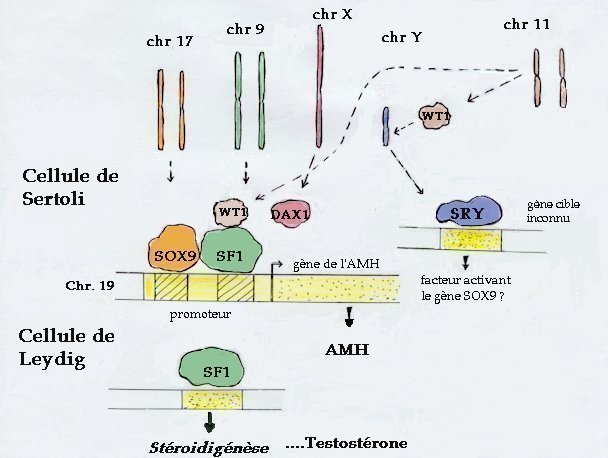
| Chez le mâle de mammifère, la détermination testiculaire est déclenchée par SRY dans les précurseurs des cellules de Sertoli. Le gène SOX9 est alors fortement transcrit et, en interaction avec SF1, initie l'expression du gène de l'AMH. L'une des isoformes protéiques du gène WT1 agit en synergie avec SF1 pour activer la transcription du gène de l'AMH. Dans les cellules de Leydig, le facteur SF1 active l'expression de gènes d'enzymes intervenant dans la stéroïdogénèse et de la testostérone est produite. Ces deux hormones testiculaires masculinisent alors les organes génitaux internes et externes. Chez la femelle, on ne connaît pas de gène déclenchant la différenciation ovarienne. On sait seulement que DAX1 inhibe l'action de SF1 et on a récemment identifié un gène (Wnt4) capable d'empêcher la différenciation des cellules de Leydig et leur production de testostérone (peut-être par l'intermédiaire de DAX1). D'autre part, chez la femelle, le niveau de transcription du gène SOX9 reste faible. |