Glossaire
Téléchargements
Jacques Barrère, Lycée Paul Louis
Courier, Tours
Une cellule en bâtonnet humaine peut être excitée par un seul photon.
Quelle est la base moléculaire de cette photosensibilité ?
Le segment externe d'un bâtonnet est spécialisé dans la photoréception. Il contient un empilement de 1000 disques environ qui sont des sacs aplatis. Ces structures membranaires contiennent des protéines photoréceptrices. La membrane plasmique d'une cellule en bâtonnet contient des canaux spécifiques des cations : ces canaux sont ouverts à l'obscurité. A l'obscurité, les ions sodium pénètrent dans le bâtonnet en suivant le gradient électrochimique. Ce gradient est entretenu par une pompe Na+-K+ ATPasique. La lumière bloque ces canaux ioniques, le flux d'ions Na+ décroît alors provoquant une hyperpolarisation de la membrane. On peut dire que l'hyperpolarisation membranaire du bâtonnet est induite par la lumière.
Un seul photon absorbé par un bâtonnet ferme des centaines de canaux ioniques et conduit à une hyperpolarisation transmise à d'autres neurones de la rétine.
Comment la lumière conduit-elle à la fermeture de canaux membranaires ?
On trouve au niveau des disques des bâtonnets une molécule photosensible appelée la rhodopsine, constituée d'une protéine, l'opsine, et d'un groupement prosthétique, le 11-cis-rétinal lié à la lysine 216 de la protéine. Le précurseur du 11-cis-rétinal est le all-trans-rétinol (vitamine A). Un déficit alimentaire en vitamine A conduit à l'héméralopie.
La rhodopsine fait partie d'une famille de récepteurs couplés aux protéines-G (les RCPGs) : Il existe environ 200 types de RCPGs, sans compter les récepteurs olfactifs couplé aux protéines-G, dont le nombre est à lui seul estimé à 400-1000 récepteurs différents. Ces protéines présentent une structure commune à sept hélices alpha transmembranaires; le 11-cis-rétinal est situé dans une poche de la protéine, près du centre de la membrane.
La rhodopsine est un RCPG un peu particulier, dans le sens où c'est un récepteur associé à son ligand. En effet, une molécule de 11-cis-rétinal est associée de manière covalente à la lysine 216 de l'hélice VII de la rhodopsine, et ce, par l'intermédiaire d'une base de Schiff. C'est l'isomérisation du 11-cis-rétinal en tout-trans-rétinal, induite par un photon, qui entraîne l'activation de la rhodopsine. La chaîne latérale d'un acide glutamique de l'hélice III constitue le contre-ion qui stabilise le 11-cis-rétinal. L'isomérisation en all-trans-rétinal provoque une rupture de cette liaison ionique qui, à son tour, entraîne un changement de conformation de la rhodopsine et une activation du récepteur.
Ce modèle de la rhodopsine montre : le récepteur membranaire comprenant 7 hélices colorées en jaune, les molécules lipidiques de la double membrane, les molécules d'eau colorées en bleue, le pigment coloré en rouge. la lysine 116 en boules et bâtonnets colorés en pourpre
La vision des couleurs est liée à l'existence dans la rétine de trois types cellulaires (les cônes) qui sont des photorécepteurs synthétisant trois pigments différents qui présentent des niveaux d'absorption différents suivant la longueur d'onde. Avec un seul des pigments, on ne voit pas les couleurs.
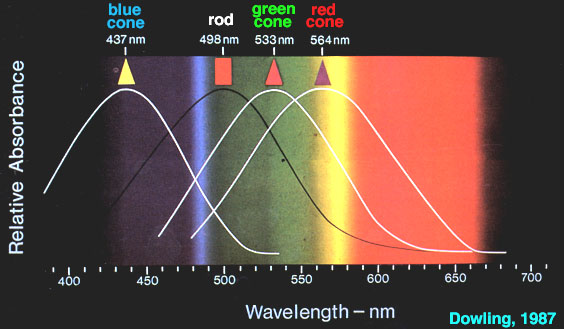
Les spectres d'absorption des trois opsines photoréceptrices ont été mesurées en éclairant des cônes avec un faisceau de lumière de 1mm seulement. Les réponses des différentes cellules en cônes montrent l'existence de trois groupes : certaines sont excitées au maximum par des longueurs d'ondes maximum de 437 nm, d'autres sont excitées des longueurs d'ondes maximum de 533 nm, et les dernières par des longueurs d'ondes maximum de 564 nm. La rhodopsine présente une bande d'absorption large dans la région visible du spectre avec un pic à 498 nm.
Les protéines photoréceptrices des cellules en cône sont, elles aussi, des récepteurs à sept hélices, les structures spatiales sont conservées; elles contiennent elles aussi le 11-cis-rétinal. Les séquences des aminoacides des protéines photoréceptrices absorbant le vert et des protéines photoréceptrices absorbant le rouge dans les cellules en cônes chez l'homme sont très semblables. Trois résidus localisés près du rétinal déterminent la différence spectrale entre les récepteurs pour le vert et pour le rouge. Le remplacement d'un résidu polaire par un résidu non polaire (par exemple, la sérine par l'alanine) à chacune de ces positions déplace lmax vers le rouge d'environ 10nm. Trois acides aminés expliquent la majeure partie de la différence de 30 nm entre les maxima d'absorption.
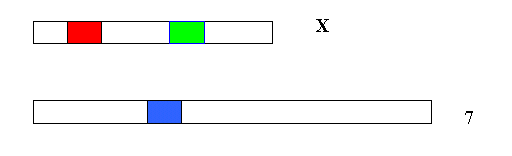
Ces protéines photoréceptrices montrent :
Protéine photoréceptrice
absorbant le rougeProtéine photoréceptrice
absorbant le vertProtéine photoréceptrice
absorbant le bleu
un modèle transmembranaire comprenant 7 hélices, le pigment coloré en rouge.
Localisation chromosomique des gènes codant pour les opsines
humaines :
Légende : gène codant pour l'opsine "sensible au rouge"
en rouge, "sensible au vert" en vert, "sensible au bleu" en bleu.
Les protéines photoréceptrices constituent une famille
de protéines largement répandues. Elles sont toutes impliquées
dans la conversion de la lumière en mouvement ionique puis en signal
nerveux. Chaque molécule photosensible contient sept hélices
alpha transmembranaires. De telles similitudes confortent l'idée
d'une origine commune.
Les séquences nucléotidiques ou les séquences peptidiques
des opsines humaines sont très semblables. Les opsines sont donc
des protéines homologues ainsi que les gènes qui les codent.
Tous ces gènes dérivent d'un même gène ancestral.
Les gènes des opsines forment une famille multigénique.
- Alignement des gènes codant pour les opsines humaines : ops_adn.seq
- Alignement des séquences peptidiques des opsines humaines : ops_pro.seq
| Séquences
peptidiques des opsines humaines
Alignement réalisé avec CLUSTAL W (1.81) multiple sequence alignment Fichier data/ops_pro.aln green
MAQQWSLQRLAGRHPQDSYEDSTQSSIFTYTNSNSTRGPFEGPNYHIAPRWVYHLTSVWM
green
IFVVIASVFTNGLVLAATMKFKKLRHPLNWILVNLAVADLAETVIASTISVVNQVYGYFV
green
LGHPMCVLEGYTVSLCGITGLWSLAIISWERWMVVCKPFGNVRFDAKLAIVGIAFSWIWA
green
AVWTAPPIFGWSRYWPHGLKTSCGPDVFSGSSYPGVQSYMIVLMVTCCITPLSIIVLCYL
green
QVWLAIRAVAKQQKESESTQKAEKEVTRMVVVMVLAFCFCWGPYAFFACFAAANPGYPFH
green
PLMAALPAFFAKSATIYNPVIYVFMNRQFRNCILQLFG-KKVDDGSELSSASKTEVSSVS
green
S--VSPA
|
On déduit de cette matrice l'arbre d'évolution probable des opsines humaines (construction effectuée avec le logiciel phylogène) :

Chaque noeud de cet arbre correspond à une duplication génique,
suivie d'une évolution indépendante des deux duplicata par
fixation de mutations différentes (les mutations apparaissant au
hasard). La première duplication est associée à une
translocation, elle marque la séparation du gène codant pour
l'opsine sensible au bleu du gène qui conduira à l'ensemble
vert/rouge. La deuxième duplication est plus récente elle
explique l'apparition de deux gènes l'un sensible au vert l'autre
sensible au rouge.
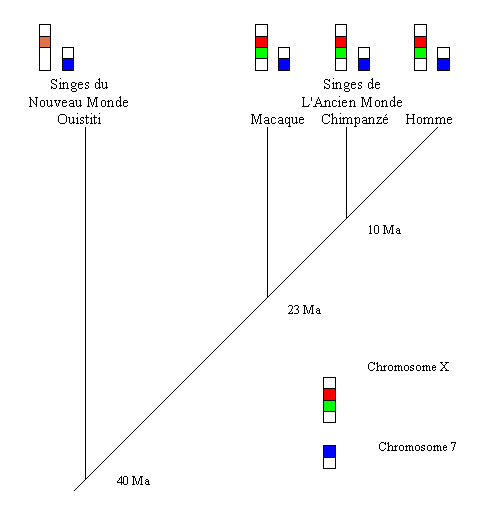
L'arbre phylogénétique de quelques Primates permet
de dater la dernière duplication à l'origine des gènes
"rouge" et "vert" portés par le chromosome X. On constate
que l'être humain, comme les singes de l'Ancien Monde (Afrique, Asie
et Europe) présente les gènes B, R et V. Les singes du Nouveau
Monde (Amérique) possèdent le gène B et un seul gène
codant pour une opsine sur le chromosome X. On en déduit que la
dernière duplication ayant affecté le gène codant
pour une opsine sur le chromosome X a eu lieu entre 40 Ma et 23 Ma.