Glossaire
Histoire
Téléchargements
Le cervelet : organisation anatomique et fonctions
Les mutants cérébelleux
Rédigée par N. Ouahioune, Lycée Montesquieu, Le Plessis-Robinson
C'est l'équipe de Sidman (Sidman et al., 1962) qui décrivit
la mutation staggerer sur la souche C57BL/6J. Elle est localisée
sur le chromosome 9. Les homozygotes (sg/sg) présentent un syndrome
ataxique grave et survivent difficilement après le sevrage (Guastavino,
1978).
| Vue externe de cervelet de souris sauvage, hétérozygotes et mutantes staggerer | |
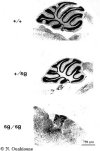 |
Coupes de cervelets de souris sauvage, hétérozygotes et mutantes staggerer |
L'utilisation d'animaux chimères (sauvages/mutants), a montré que la mutation "sg" s'exprimait directement dans les cellules de Purkinje et que l'atteinte des neurones olivaires et des cellules des grains était indirecte, vraisemblablement secondaire à celle de leur cible (Herrup, 1979, 1981, 1983; Shojaeian et al., 1990) .
D'autres expressions phénotypiques de la mutation ont été décrites: c'est le cas en particulier de la persistance de marqueurs de surface membranaires de type embryonnaires chez les mutants adultes. La conversion des résidus acides polysialiques alpha 2---6 en résidus alpha 2---8 ne s'opère pas au cours du développement du mutant staggerer (Trenkner and Sarkar, 1977). De même, la conversion de la forme embryonnaire (E) en forme adulte (A) de la molécule d'adhésion N-CAM, qui correspond à une désialylation de la molécule n'a pas lieu au bout de trois semaines de vie post-natale chez le mutant, alors qu'elle est complète chez le témoin (Edelman and Chuong, 1982). Ces anomalies biochimiques sont liées à un déficit de l'activité d'une neuraminidase dans le cervelet, empêchant ainsi le processus de coupure des acides sialiques nécéssaires à la maturation des molécules de surface (N-CAM). L'activité de cette enzyme passe par deux pics, respectivement au 3 ème et 21 ème jour post-natal. Le pic d'activité du 3 ème ne survient pas dans le cervelet des mutants (Wille and Trenkner, 1981) .
Par ailleurs, Messer et coll., (Messer and Hatch, 1984; Messer et al., 1981) ont mis en évidence une réduction de la concentration en thymidine kinase dans le cervelet du mutant malgré une activité enzymatique comparable à celle observée chez les animaux normaux, ainsi qu'un déficit des messagers de la calmoduline dans les cellules de Purkinje (Messer et al., 1990). La souris staggerer présente donc un ensemble de manifestations phénotypiques extrêmement variées.
Le mutant staggerer semble aussi présenter une susceptibilité exagérée à l'athérosclérose vraisemblablement liée à une baisse de HDL(Matmontova et al.,1995)
Récemment, le gène staggerer a été cloné et il a été montré qu'il correspondait au facteur de transcription ROR alpha qui est un récepteur nucléaire appartenant à la même famille que les récepteurs à l'acide 9-cis-rétinoique (Hamilton et al., 1996). La mutation staggerer correspond à une délétion se produisant dans la partie du gène codant pour le site de liaison sur le DNA. La cascade des phénomènes qui relient cette délétion aux différents phénotypes décrits reste à élucider.
B - La mutation reeler (rl)Reeler est une mutation récessive autosomique de la souris, localisée
sur le chromosome 5, qui affecte le développement embryonnaire du
cerveau. Elle atteint essentiellement les structures laminées comme
le cervelet (Sidman, 1968; Rakic and Sidman, 1972; Mariani et al., 1977),
le cortex cérébral et l'hippocampe (Steindler and Colwell,
1977; Goffinet, 1984; Heckroth et al., 1989).
| Vue externe de cervelet de souris sauvage, hétérozygotes et mutantes reeler | |
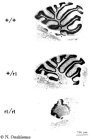 |
Coupes de cervelets de souris sauvage, hétérozygotes et mutantes reeler |
Recemment, le gène de la souris normale a été cloné par l'équipe de d'Arcangelo et al. (D'Arcangelo et al., 1995). Ce gène s'exprimerait très tôt dans le développement et coderait pour une protéine qui a été appelée "Reelin", et qui pourrait être une protéine de la matrice extracellulaire. L'ARNm de la Reelin peut être détecté dans le cerveau embryonnaire de souris à partir du 12e jour (E12). Sa concentration augmente au cours du développement pour être maximale autour de la naissance et la période périnatale, puis diminue progressivement et persiste à des taux très bas dans le cerveau adulte. Le gène muté des souris reeler de l'allèle Orléans (souris utilisées pour cette étude), résulterait d'une délétion d'un exon du messager de la reelin (Bar et al., 1995) qui entraînerait un cadre de lecture tronqué et probablement la production d'une protéine tronquée. L'équipe de Ogawa (Ogawa et al., 1995) a montré de façon concomitante que les neurones de Cajal-Retzius chez la souris normale secrétaient une protéine, qui jouerait un rôle primordial dans le développement cortical. Cette protéine pourrait justement être la reelin. Les cellules de Cajal-Retzius sont présentes chez la souris reeler mais la mutation n'affecterait ni leur position ni leur différentiation bien que le cortex soit très anormal. Une explication de ces anomalies pourrait résider dans le fait que les cellules de Cajal-Retzius chez le mutant reeler secréteraient cette protéine tronquée dans la matrice extracellulaire locale de la zone marginale et influenceraient le développement du cortex en agissant sur les neurones de la plaque corticale et/ou sur l'écheveau des fibres gliales radiaires qui guident la migration neuronale (Goffinet, 1995; Rakic and Caviness, 1995).