Mise
à jour : 23/10/2001
Glossaire
Histoire
Téléchargements
|
Rédigé par J-Y. Dupont, IA-IPR,
Orléans-Tours
Ce point scientifique est fortement inspiré de :
-
A. Stary, A. Sarasin : Xeroderma pigmentosum. La presse médicale
n° 40, 20 décembre 1997).
-
S. Doumer Queille : Rôle des ultraviolets dans la carcinogénèse
cutanée. Thèse de l'université Paris XI, Avril 2001.
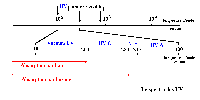
Rayonnement solaire
et rayons Ultra-Violets
| Aux extrémités du spectre
de la lumière visible, le rayonnement solaire comporte des infra-rouges
et des ultra-violets. Le spectre UV est divisé en plusieurs régions
: les UV de haute énergie (UVC) qui sont filtrés par la couche
d'ozone, les UVB (qui représentent 0,3% du rayonnement parvenant
à la surface de la Terre) et les UVA (0,1%).Toutefois, dans certaines
régions du globe, la fragilisation de la "couche" d'ozone tend à
élargir vers les UVC le spectre solaire parvenant à la surface
de la terre . |
 Cliquer pour agrandir
Cliquer pour agrandir
|
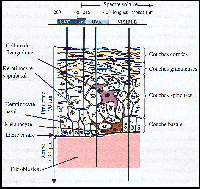
La peau
Elle est constituée de l'épiderme
et du derme.
L'épiderme peut être subdivisé
en quatre couches.
Des kératinocytes indifférenciés
prolifèrent au niveau de la lame basale et migrent vers les couches
supérieures en subissant des modifications morphologiques et biochimiques.
La différenciation terminale est la transformation en cellules cornées,
mortes, en fome d'écailles qui constituent la barrière protectrice.
D'autres types cellulaires sont présents
dans l'épiderme : des mélanocytes, dans la couche basale,
produisant les mélanines (protection contre les UV) et des cellules
de Langerhans intervenant dans la réponse immune.
Le derme est constitué de fibroblastes.
Il renferme aussi des adipocytes impliqués dans la régulation
de la température. |
 Cliquer pour agrandir
Cliquer pour agrandir
|
Peau et UV
Les UVC (haute énergie) pénètrent
faiblement dans la peau. Les UVB (5% des UV) pénètrent plus
profondément et atteignent la couche basale de l'épiderme.
Les UVA (9,5% des UV) pénètrent jusqu'au derme.
L'agression de la peau par les UV peut induire
des tumeurs cutanées :
-
les mélanomes malins qui sont des tumeurs
malignes très agressives et métastasiques provenant des mélanocytes.
Bien que n'étant pas particulièrement localisés sur
les zones corporelles exposées au soleil, l'exposition semble impliquée
dans l'induction de ces mélanomes.
-
les carcinomes cutanés qui peuvent avoir pour
origine les cellules de la couche spineuse (carcinome spinocellulaire ou
SCC) ou celles de la couche basale (carcinome basocellulaire ou BCC). L'âge
moyen de la survenue est entre 50 et 60 ans. Les études épidémiologiques
et expérimentales montrent que les carcinomes cutanés sont
liés à l'exposition solaire : ils sont principalement localisés
dans les zones photo-exposées ; il y a corrélation entre
leur incidence et les faibles latitudes, la clarté de la peau,
la déficience de la réparation des photolésions chez
certains sujets ( cas du xeroderma pigmentosum).
L'induction des carcinomes cutanés est liée
à des photolésions du gène p53 induites
par les UVB. Des mutations du gène ptch (gène
suppresseur de tumeur) sont également associés au développement
de certains carcinomes cutanés.
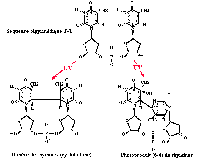
ADN et UV
Les UV peuvent causer des dommages sur l'ADN,
les ARN et sur les protéines. Les effets majeurs sont cependant
les modifications produites directement par l'absorption des photons (émis
par les UVC et les UVB) par les bases de l'ADN.
L'énergie absorbée
induit le plus souvent la formation d'une liaison covalente entre deux
pyrimidines adjacentes sur un même brin formant un dimère
de pyrimidine (DP).
On peut avoir 2 liaisons covalentes entre les
C5 et les C6 de deux pyrimidines adjacentes. Cette dimérisation
peut concerner les quatre types de séquences bipyrimidiques (TT,TC,CT,CC).
Une liaison peut également s'établir
entre les C6 et le C4 de deux pyrimidines adjacentes plus fréquemment
sur des sites TC (quelquefois CC et TT). |
Cliquer pour agrandir
|
Les dimères de pyrimidines ont pour conséquence
une distorsion de la double hélice avec des répercussions
sur la transcription, la réplication, la fixation des protéines
qui se lient à l'ADN. Ces déformations sont de fortes courbures
de l'ADN (7 à 44°).
Les mutations photo-induites
Certaines lésions de l'ADN peuvent bloquer
la réplication. Toutefois certaines polymérases peuvent contourner
la lésion. Dans ce cas , les mutations ponctuelles sont dues à
l"incorporation d'une base incorrecte en face d'une lésion non réparée.
La majorité des mutations sont des substitutions de bases : transition
GC/AT, mutation en tandem CC vers TT.
Les cellules irradiées en phase G1 du cycle
cellulaire ont le temps de réparer leur ADN si les lésions
concernent le brin transcrit. Les mutations sont, dans ce cas, dues à
la réplication des lésions situées sur le brin non
transcrit.
Une irradiation en phase S ne laisse pas le temps
d'une réparation de l'ADN avant la réplication. Les mutations
résultent alors de la réplication des lésions situées
sur le brin transcrit.
La réparation
de l'ADN
Plusieurs processus permettent de détecter
et réparer les lésions induites sur l'ADN.
1 - La photo-réactivation
Elle est induite par la lumière et est
catalysée par des ADN photolyases : l'enzyme provoque la cassure
des liaisons C5-C6, C6-C6 ou C4-C6.
2 - La réparation par excision de bases
(BER)
Elle consiste en un retrait des bases modifiées
lorsque celles-ci n'entraînent pas de distorsion de la double hélice.
Les bases modifiées sont purement et simplement enlevées
par des glycosylases et des endonucléases.
3 - La réparation par excision de nucléotides
(NER)
Elle est impliquée dans le retrait de
lésions volumineuses qui provoquent une distorsion de la double
hélice. Il existe deux voies de réparation :
-
la réparation couplée à la transcription
qui concerne la réparation rapide des lésions situées
sur le brin transcrit et affectant des gènes en cours de transcription.
-
la réparation globale du génome qui
concerne la réparation lente de l'ADN pour des gènes qui
ne sont pas en cours de transcription.
Il y a une hiérarchisation selon trois niveaux
: d'abord la réparation préférentielle et rapide sur
du brin transcrit, puis la réparation du brin non transcrit, enfin
la répartion lente des régions non actives.
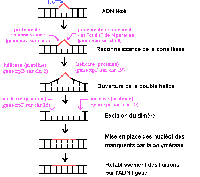
La NER, chez les Mammifères,
se déroule en 4 étapes :
1 - Recherche et reconnaissance de la lésion
2 - Ouverture de la double hélice au niveau
de la lésion
3 - Incision de part et d'autre de la lésion
puis excision pour éliminer le fragment d'ADN portant la lésion
4 - Resynthèse puis ligation.
Chez l'Homme, une trentaine de protéines
sont impliquées. Seules certaines d'entre elles seront envisagées
ici. |
 Cliquer pour agrandir
Cliquer pour agrandir
|
-
La recherche et la reconnaissance de la lésion
La protéine xpC, associée à
une autre protéine assurerait ce rôle de recherche et de reconnaissance.
Elle intervient dans la fixation de la protéine xpA sur l'ADN endommagé.
XpAest une protéine de 273 acides aminés à 4 doigts
de zinc impliqués dans la liaison sur l'ADN. Elle participe au recrutement
des autres protéines de la NER. Elle est codée par le gène
xpA situé sur le chromosome 9. Le gène xpC est localisé
sur le chromosome 3.
-
L'ouverture de la double hélice
L'ouverture de la double hélice, sur environ
25 paires de bases, requiert l'intervention des hélicases
xpD et xpB qui préparent les étapes d'incision qui suivent.
La protéine xpD (ou ERCC2) comporte 760 acides aminés. Elle
est codée par un gène situé sur le chromosome 19.
La protéine xpB (ou ERCC3), comportant 782 acides aminés,
est codée par un gène du chromosome 2.
-
L'incision de part et d'autre de la lésion
et l' excision
Elle est catalysée par deux endonucléases
xpG (ou ERCC5) et xpF (ou ERCC4) qui coupent respectivement en 3' et 5'
de la lésion, incisant ainsi un fragment de 27 à 29 nucléotides.
Elles clivent spécifiquement la molécule d'ADN au niveau
où les deux brins se désolidarisent. La protéine xpG
incise d'abord en 3' puis xpF en 5'. Les incisions n'interviennent que
si la double hélice a été préalablement ouverte.
xpG est une protéine de 1186 acides aminés, codée
par un gène situé sur le chromosome 13 ; xpf a 916 acides
aminés codés par un gène du chromosome 16.
-
La resynthèse puis ligation
Plusieurs protéines sont impliquées.
Elles interviennent notamment dans le recutement des ADN polymérases
qui "comblent la brèche". Les extrémités sont ensuite
jointes par l'intermédiaire d'une ligase.
Dans le cas d'une réparation couplée
à la transcription, c'est le blocage de l'ARN-polymérase
au niveau de la lésion qui permettrait de recruter des protéines
de couplage transcription-réparation (CS-A et CS-B) et déclencherait
ainsi les mécanismes de réparation. Dans le génome
inactif, c'est la protéine xpC associée à d'autres
protéines qui assurerait ce rôle de recherche des lésions.
Le xeroderma pigmentosum (=XP)
C'est une affection génétique rare
transmise sur le mode autosomal récessif avec une fréquence
d'environ 1/106 en Europe et aux Etats Unis, de 1/105
au Japon et en Egypte. Dans ces derniers cas, 30% des parents de sujets
atteints de XP sont consanguins et 21% cousins au premier degré.
Principales
caractéristiques cliniques
-
Anomalies de la pigmentation de la peau : dans la forme commune du XP,
les premiers signes apparaissent dès 1 à 2 ans. C'est d'abord
une hypersensibilité aux rayons UV du soleil (érythèmes
intenses), puis des altérations de la peau exposée (sécheresse
cutanée, taches hyperpigmentées, kératoses).
-
Apparition de tumeurs : elles sont cutanées ou ophtalmologiques
et apparaissent dès l'âge de 8 ans. La fréquence des
cancers cutanés est multipliée par 4800 chez les sujets de
moins de 20 ans par rapport à un groupe témoin.
-
Anomalies ophtalmologiques : ce sont des inflammations de la conjonctive
et de la cornée qui se manifestent dès l'âge de 4 ans
avec quelquefois des mélanomes sur les paupières.
-
Anomalies neurologiques : 20% des malades XP ont une perte progresive de
neurones du cortex cérébral entrainant des troubles neurologiques
sévères. Ceci s'expliquerait par un déficit de l'activité
de la catalase (enzyme de détoxification cellulaire) des cellules
nerveuses.
-
Evolution : l'espérance de vie des patients XP est réduite
de 30 ans en moyenne par rapport à une population témoin.
|
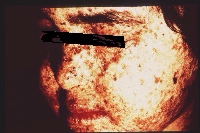 Cliquer pour agrandir
Cliquer pour agrandir
|
Les caractéristiques
cellulaires
| Les cellules cultivées in vitro provenant de malades
XP ont, après irradiation aux UVC, une fréquence de mutations
beaucoup plus importante que les cellules normales soumises aux mêmes
agents. La présence de lésions non réparées
provoque, lors de la réplication de l'ADN endommagé, l'insertion
de bases anormales en face des lésions et induisent ainsi des mutations
dans le génome des cellules filles.
La fréquence particulièrement importante de cancers cutanés
dans les zones exposées au soleil est corrélée avec
le taux élevé de mutations détectées sur plusieurs
loci. |
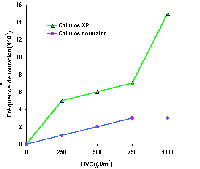 Cliquer pour agrandir
Cliquer pour agrandir
|
Le spectre de mutation particulièrement caractéristique
de l'action des UVC (transition C vers T, double mutation CC vers TT) est
retrouvé sur les oncogènes ras activés
et sur le gène suppresseur p53 dans les cellules tumorales
des patienst XP.
Les caractéristiques génétiques
et biochimiques
Dans les cellules XP, une des premières étapes de la réparation
par excision-resynthèse (NER) est déficiente. La plupart
des gènes de réparation impliqués ont été
identifiés : les méthodes ont reposé le plus souvent
sur l'introduction dans des cellules sensibles aux UV de fragments d'ADN
restaurant chez ces cellules un comportement normal. Le clonage et séquençage
de ces gènes ont permis de connaitre la séquence en acides
aminés des protéines impliquées et ainsi de déduire
la fonction de ces enzymes.
Au moins huit gènes seraient impliqués dans le syndrome
XP.
Le diagnostic
anté-natal
L'UDS (Unscheduled DNA
Synthesis) est la méthode biologique la plus fréquemment
utilisée.
Des cellules préalablement irradiées
aux UV sont mises en présence de thymidine tritiée. Une cellule
normale incorporera d'autant plus de ce précurseur radioactif pour
réparer son ADN que la dose d'UV reçue aura été
plus importante. Une cellule XP, incapable de réparer correctement
les dommages, n'incorporera que peu de précursseur marqué.
La mesure est effectuée par autoradiographie
en comptant le nombre de grains d'argent par noyau. |
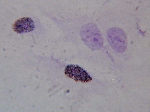
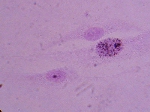
Cliquer pour agrandir
|
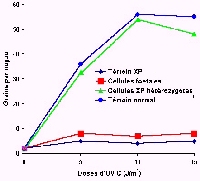
| Cette méthode est
appliquée sur des cellules foetales cultivées in vitro provenant
de biopsie de trophoblaste ou de liquide amniotique. L'efficacité
de réparation de l'ADN est comparé à celle de cellules
issues de biopsie de peau des parents normaux. |
Cliquer pour agrandir
|
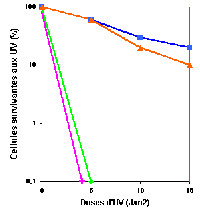
Traitement
La prévention en mettant l'individu à
l'abri de la lumière reste la meilleure solution thérapeutique.
On pratique l'ablation chirurgicale de tumeurs et l'utilisation de
composés rétinoïdes pour empêcher la progression
tumorale. On utilise également l'autogreffe d'une partie de la peau
non exposée au soleil.
L'identification des gènes impliqués a conduit à
établir des protocoles de thérapie génique cellulaire
: la culture in vitro de kératinocytes de patients atteints de XP
permet de réaliser la "reversion phénotypique" de ces cellules
par transfert des gènes déficients de réparation de
l'ADN à l'aide de vecteurs retroviraux. |
Cliquer pour agrandir
|
|









