
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
La tête de l'épididyme (en haut) est assez volumineuse, le corps de l'épididyme longe le testicule et la queue de l'épididyme est la zone où les spermatozoides son stockés.
D'après http://spermiologie.u-strasbg.fr
Elles sont aptes à féconder un ovocyte mûr par fécondation assistée mais les embryons qui en sont issus se développent beaucoup moins longtemps que des embryons provenant de fécondation ICSI par spermatozoide.
Acquisition du pouvoir fécondant des spermatozoides au cours de leur progression dans l'épididyme.
 |
|
|||||||||||||||||||||
| Représentation de l'épididyme et de ses
relations avec le testicule
La tête de l'épididyme (en haut) est assez volumineuse, le corps de l'épididyme longe le testicule et la queue de l'épididyme est la zone où les spermatozoides son stockés. D'après http://spermiologie.u-strasbg.fr |
C'est seulement à partir du début de la queue de l'épididyme que les spermatozoides de la plupart des mammifères possèdent la double aptitude, mobilité et fixation à la zone pellucide. |
Chez les mammifères, la durée de passage des spermatozoides dans l'épididyme est variable selon les espèces, elle est d'environ une dizaine de jours, chez l'homme. Le temps de séjour le plus long correspond au temps de résidence dans la queue de l'épididyme. Cette partie sert en effet de réservoir de spermatozoides entre deux éjaculations, et les spermatozoides peuvent y survivre plus de trois semaines.
C'est à partir du corps de l'épididyme que les spermatozoides
deviennent aptes à un déplacement linéaire, mais cette
potentialité ne peut s'exprimer, à cause des caractéristiques
du milieu épididymaire environnant.
En effet; le liquide épididymaire a une composition très
particulière, son volume est fortement diminué suite à
une intense réabsorption d'eau, sa pression osmotique est forte
(400 mOsmol), ce qui permet l'immoblisation et la survie des spermatozoides.
De plus, la forte différence de température de l'épididyme
par rapport au corps (-7°C chez le rat) participe à la réduction
de mobilité des spermatozoides.
Cette aptitude, acquise au cours du passage dans l'épididyme, met en oeuvre des structures d'adhésion entre les glycoprotéines de la zone pellucide et des recepteurs spermatiques qui peuvent être des enzymes, ou de simples protéines. Elle est indépendante de l'acquisition de la mobilité.
La capacité à se fixer sur la zone pellucide dépend
de protéines qui apparaissent au niveau de l'acrosome.
Certaines protéines indispensables à la fixation du speratozoide
sur la zone pellucide existent déjà sur le spermatozoide,
à la fin de la spermiogénèse. C'est le cas de la galactosyltransférase,
qui reconnaît spécifiquement, chez la souris, l'extremité
N-acétyl-glucosamine de la protéine ZP3
(zone pellucide), et assure la fixation. Cependant, comme les spermatozoides
n'acquierent la possibilité de se fixer sur la zone pellucide qu'au
cours du transit épididymaire, les sécrétions de cette
structure interviennent donc dans sa maturation. Par exemple la déglycosylation
de la protéine Spam-1 (souris) est nécessaire à sa
fixation à la zone pellucide.
Ainsi, à la fin de sa maturation, la membrane du spermatozoide est-elle organisée en cinq domaines principaux, caractérisés chacun, par un ou plusieurs types de protéines (on note une modification de la répartition de certaines protéines au cours de la maturation, par migration au sein de la membrane), et assurant une fonction spécifque:
Les sécrétions de l'épididyme protègent
les spermatozoides durant leur transit dans les voies géniatles
mâle. Une protection complémentaire leur est fournie par sécrétions
des glandes annexes (vésicules séminales, prostate). Pour
que la capacitation puisse se produire, il faut d'abord que ces sécrétions
soient éliminées.
In vivo, c'est au cours du passage du col qu'elles le sont. In vitro
(FIV), c'est par centrifugation douce ou migration ascendante spontanée
des spermatozoides dans un dilueur que ce phénomène est obtenu.
La capacitation, elle-même, a lieu, in vivo, uniquement dans l'utérus et dans les trompes. Elle ne dépend pas de l'espèce. Elle est placée sous le contrôle des stéroides ovariens (elle ne peut avoir lieu pendant la phase lutéale). Elle met en jeu plusieurs mécanismes dont l'enlèvement de protéines liées à la membrane du spermatozoide, l'enlèvement du cholestérol libre et le remaniement de chaînes oligosaccharidiques de protéines intramembranaires du spermatozoide, par différentes sécrétions des voies génitales femelles, comme l'albumine (accepteur de cholestérol) ou des enzymes.
In vitro, la capacitation s'obtient notamment en présence d'albumine, et pour des concentrations élevées de spermatozoides (les enzymes acrosomiques libérées par les spermatozoides morts contribueraient à modifier les chaînes oligosaccharidiques des protéines membranaires des spermatozoides intacts)
Ces changements membranaires rendent apparents les récepteurs spermatiques assurant la fixation à la protéine ZP3, augmentent la perméabilité de la membrane du spermatozoide aux ions Ca++ (ces deux premiers changements rendent possible la réaction acrosomique) et provoquent un changement de la mobilité du spermatozoide qui devient "hyperactif " et perd sa progression linéaire au profit d'une nage circulaire.
 |
|
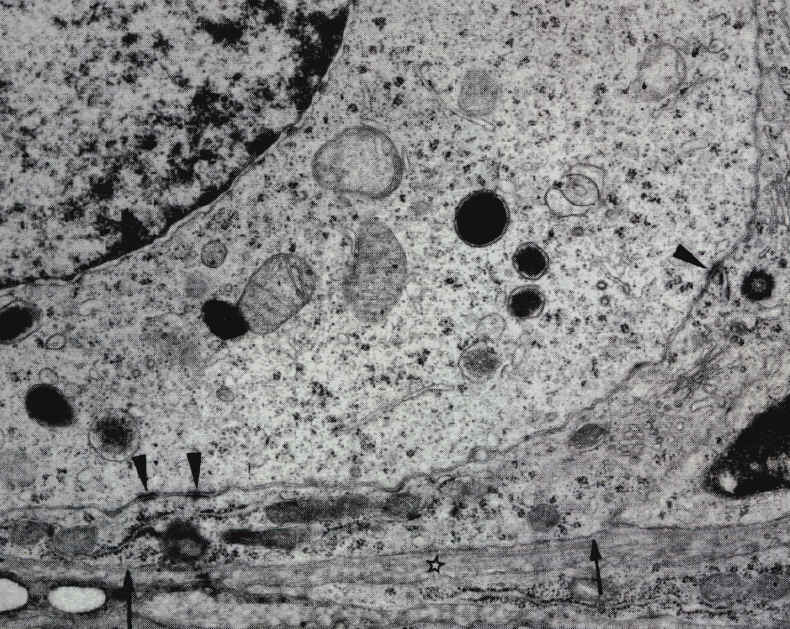
On peut observer trois jonctions adhérentes (pointes de flèche) entre la membrane de l'ovocyte I et une cellule folliculaire aplatie. Cette cellule est entourée par une couche de collagène (étoiles) et séparée d'elle par une membrane basale (flèches), future séparation entre granulosa et thèques. Microscopie électronique (x7500) |
L'ovocyte reste bloqué en fin de prophase méiotique pendant
toute la croissance folliculaire.
Il acquiert d'abord la compétence à reprendre sa méiose,
il subit alors la maturation nucléaire, puis la maturation cytoplasmique
lui permet d'acquérir sa compétence à assurer fécondation
et développement.
 |
|
|
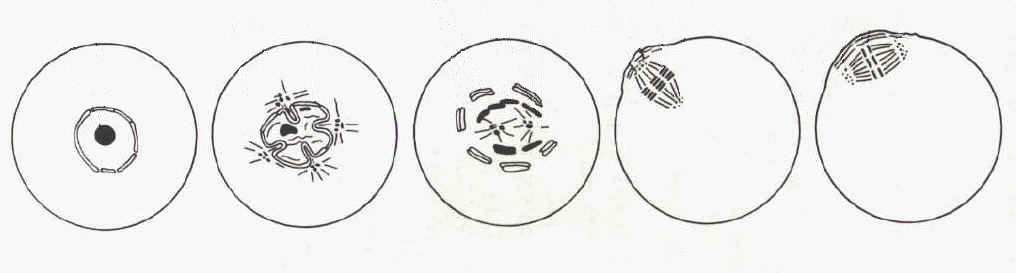
Le premier signe visible de la reprise du processus de méiose est le plissement de l'enveloppe de la vésicule germinale. Ensuite les pores de cette enveloppe disparaissent et elle se rompt. La rupture de la vésicule germinative (GVBD: germinal vesicle breakdown) dure quelques heures.
La condensation des chromosomes a lieu parallèlement à
ce phénomène membranaire, elle implique l'arrêt de
la transcription.
Les microtubules s'organisent en fuseau et la plaque métaphasique
(Métaphase I) se forme, cela prend une douzaine d'heure chez la
souris. L'anaphase (qui voit la séparation de deux lots haploides
de chromosomes à deux chromatides) et la télophase suivent
rapidement. Il en résulte l'expulsion du premier globule polaire.
Du point de vue du cycle cellulaire, la reprise de la méiose
correspond à un passage du stade G2 au stade M. La phase S a eu
lieu à la fin des divisions des ovogonies, avant la différenciation
des vogonies en ovocytes I, dans l'ovaire foetal.
Comme toute entrée en division, cette étape est contrôlée par le MPF (M-phase promoting factor). Cette molécule est un complexe de 2 protéines (P34cdc2 et cycline B) dont l'activité dépend de l'état de phosphorylation (le pré-MPF est à l'état phosphorylé, il doit être déphosphorylé pour devenir le MPF actif). Les mécanismes d'activation de cette molécule varient avec l'espèce de mammifère considérée, ceci explique les différences de latence entre le début des modifications de l'enveloppe nucléaire et la GVBD.
Le MPF activé présente notamment une grande affinité pour l'histone H1 et certaines protéines associées aux microfilaments. Il est ainsi considéré comme directement responsable de la condensation des chromosomes et des remodelages du cytosquelette. Etant responsable de la phosphorylation de l'ARN-polymérase II et de facteurs d'élongation, il est également considéré comme l'inducteur des néosynthèses protéiques observées lors de la reprise de méiose.
Après cette première division, le niveau de MPF actif
baisse, mais pas suffisamment pour permettre la décondensation des
chromosomes. Grâce aux néosynthèses (notamment de cycline
B), l'activité du MPF reprend et les chromosomes s'arrangent de
nouveau en plaque métaphasique (Métaphase II).
L'ovocyte II sera alors bloqué à ce stade à cause
d'un facteur cytostatique (CSF: cytostatic factor), dont la nature n'est
pas encore élucidée. Il se pourrait qu'une protéine
du cytoplasme ovocytaire, produit du proto-oncogène cmos,
en soit un des composants. Il est en effet indispensable à l'activation
du MPF.
D'autre part on sait depuis longtemps que l'ovocyte, une fois sorti
de son contexte folliculaire, reprend spontanément sa méiose.
Il existe donc une substance inhibitrice de cette reprise (OMI: oocyte
meiotic inhibitor), d'origine folliculaire.
Il se pourrait que ce soit l'AMPc, second messager des hormones gonadotrophines,
dont le taux plasmatique est élevé en période pré-ovulatoire.
En effet, chez les rongeurs, des molécules augmentant le niveau
d'AMPc sont capables de prolonger le blocage méiotique in vitro.
Lors du processus d'ovulation, une rupture des jonctions perméables
entre l'ovocyte et les pieds des cellules folliculaires et une expansion
du cumulus se produisent (séparation des cellules du cumulus par
rupture des jonctions perméables les unissant). Ceci entraîne
la rupture de la transmission du signal OMI (l'AMPc?) vers l'ovocyte, et
la reprise de sa méiose, avec expulsion du 1er GP. En effet l'AMPc
contenu dans le liquide folliculaire lui-même ne peut bloquer la
métaphase II, son action est véhiculée par les jonctions
perméables des cellules de la corona avec l'ovocyte.
 |
 |
|
Microscopie photonique (x1800) |
Microscopie électronique (x37 000) |
On désigne par
- acquisition de la compétence méiotique,
l'ensemble des phénomènes cytoplasmiques précédant
la reprise de méiose,
et par
- maturation cytoplasmique, ceux
qui accompagnent le déroulement de la méiose, à la
suite du signal ovulatoire de LH, et donnent à l'ovocyte sa compétence
à assurer fécondation et développement..
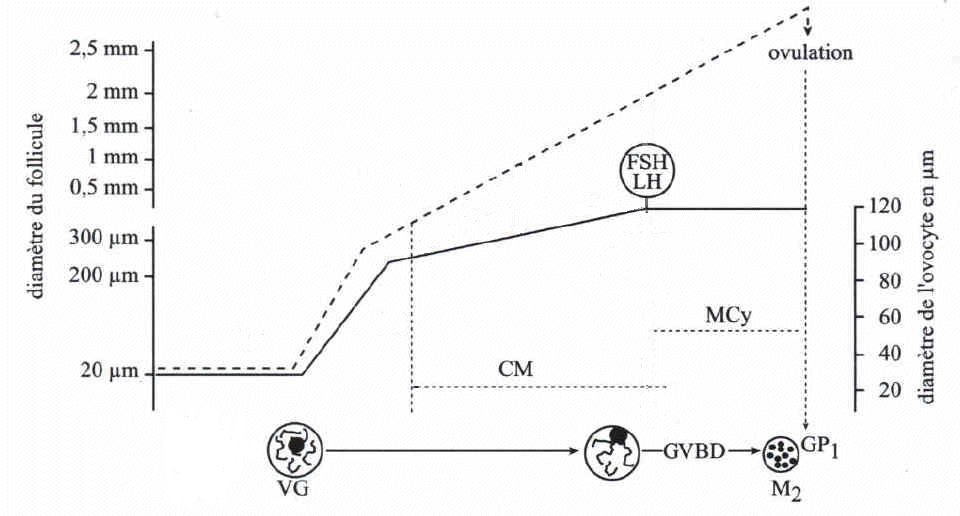
La prépartion à la maturation commence par une croissance
spectaculaire de l'ovocyte qui passe d'un diamètre de 20 à
30 micromètres à un diamètre de 120 micromètres
environ (multipliant ainsi son volume par 300). Cette croissance s'opère
principalement du stade de follicule primaire au stade de follicule pré-antral
(80% de la croissance est réalisée à ce stade). Elle
est dépendante des cellules folliculaires qui sont en relation étroite
(jonctions perméables) avec la membrane cytoplasmique de l'ovocyte.
 |
|
La croissance du follicule (ligne pointillée, échelle à gauche), et celle de l'ovocyte (ligne continue, échelle à droite) évoluent parallèlement. La croissance ovocytaire est nulle durant le stade de follicule primordial, forte pendant le stade follicule primaire puis plus faible pendant le stade de follicule secondaire. A la fin du stade de follicule secondaire, le pic ovulatoire entraîne la reprise de méiose (GVBD). Dès le début du stade follicule secondaire, l'ovocyte I présente une compétence à la méiose (CM), celle-ci est, in vivo, inhibée par le follicule environnant. Après le pic ovulatoire, l'ovocyte II a acquis la compétence à la fécondation et au développement, il a opéré sa maturation cytoplasmique (MCy). |
Une différenciation du cytoplasme a lieu parallèlement.
Les mitochondries rondes s'accumulent d'abord dans le cytoplasme, au
voisinage du reticulum endoplasmique rugueux, puis migrent dans le cortex
ovocytaire durant la phase finale de maturation.
L'appareil de Golgi passe également par une phase d'activité
intense, participant à la formation de la zone pellucide et des
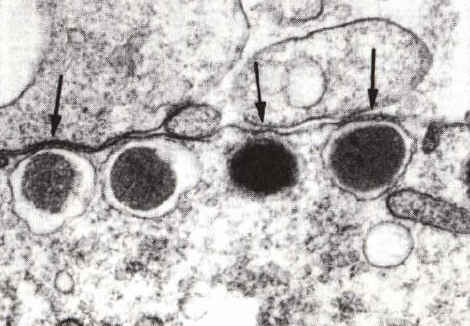
granules corticaux.Ces granules sont de petites vésicules (200 à
600 nm) qui se positionnent contre la membrane plasmique dans la phase
finale de maturation de l'ovocyte. Ils joueront un rôle capital lors
de la fécondation, en empêchant la polyspermie.
 |
|
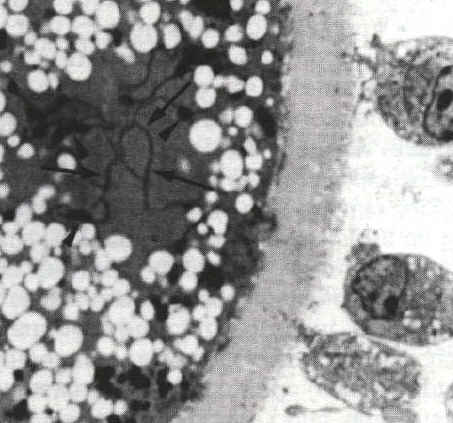
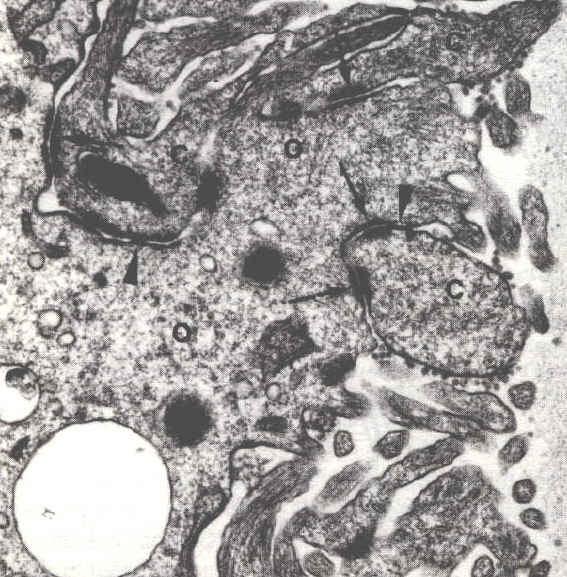
Les granules corticaux migrent, dans les ovocytes de follicules préovulatoires, sous la membrane de l'ovocyte. De petits ponts (flèches) se forment entre la membrane de ces vésicules et la face interne de la membrane cytoplasmique de l'ovocyte. Ces éléments du cytosquelette seront impliqués dans les processus d'exocytose. Microscopie électronique (x1800) |
Par ailleurs, durant sa croissance, l'ovocyte accumule de grandes quantités
d'ARN,
augmentant d'environ 300 fois son contenu en ARN total. Les transcriptions,
d'abord très intenses, diminuent fortement lorsque l'ovocyte a atteint
80% de sa taille définitive. Les 2/3 sont des ARN ribosomiaux, reflet
de l'intense activité nucléolaire. Les ARN messagers représentent
environ 10% des ARN totaux et ont une stabilité particulièrement
élevée.
De même, la capacité de synthèse protéique
de l'ovocyte est d'abord élevée, puis diminue au cours de
sa croissance. Les trois types de protéines de la zone pellucide
(ZP1, ZP2 et ZP3) représentent, à
elles seules, 10% des synthèses protéiques totales de l'ovocyte.
L'ensemble des connaissances relatives à la maturation de l'ovocyte a permis de mettre au points des protocoles de maturation in vitro de l'ovocyte, porteurs de nombreux espoirs dans le domaine de la procréation médicalement assistée.
Bibligraphie:
Sauf indication contraire, les illustrations sont tirées de l'ouvrage: "La reproduction chez les mammifères et chez l'homme", C.Thibault, Ellipses INRA , avec l'aimable autorisation du regretté Pr Charles Thibault, pour les iconographies de la première édition de 1991.
P Mermillod et R Marchal, La maturation de l'ovocyte de mammifères, médecine/sciences 1999, 15, 148-156,