Glossaire
Histoire
Téléchargements
Suivi histologique de la différenciation sexuelle chez la souris
Aspects techniques
Les photos de cette page sont de F. Jauzein. Leurs copie et utilisation, sans but lucratif et à des fins éducatives, sont autorisées.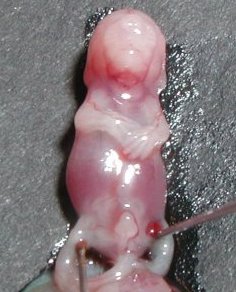
Prélèvement des embryons sur des souris gravides
Des embryons de souris ont été prélevés
sur des souris gestantes, à 11 jours post coïtum (jpc), 13
jours et 15 jours. La durée totale de gestation chez la souris est
de 20 jours environ. La série d'images ci-dessous présente
les étapes du prélèvement et de la préparation
avant inclusion, des embryons de 15 jpc d'âge.
 |
 |
 |
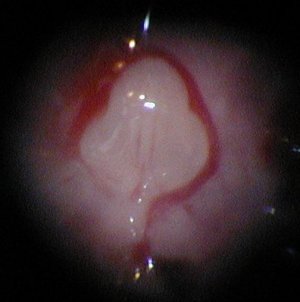 |
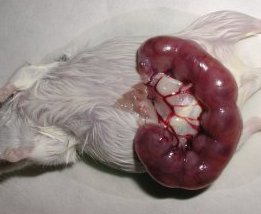
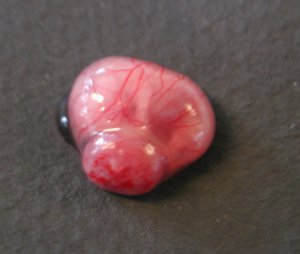
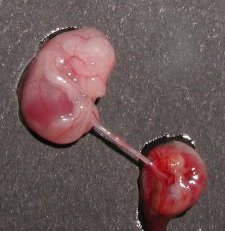
- L'abdomen de la souris est ouvert et l'utérus est dégagé.
- Chaque embryon apparaît entouré de son amnios. - Une fois l'amnios ôté, le placenta et le cordon ombilical appraissent. - L'embryon ne présente, à ce stade du développement, aucun caractère phénotypique externe permettant d'identifier son sexe. - Le tubercule génital visible alors est encore indifférencié. |
Afin de connaître le sexe de l'animal sans le disséquer,
(ou lorsqu'aucun caractère anatomique sexuel externe ou interne
n'existe), une technique dite de la "sex-chromatine" (visualisation de
l'hétérochromatine sexuelle ou corpuscule de Barr) peut être
pratiquée. La présence de l'hétérochromatine
sexuelle, sous forme d'une petite zone sombre d'hétérochromatine
plaquée contre l'enveloppe nucléaire, signe le sexe femelle
; elle correspondant à l'un des chromosomes X inactivé dans
ce type de cellules.
 |
 |
 |
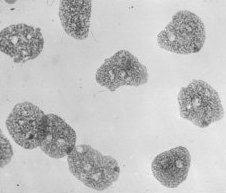 |
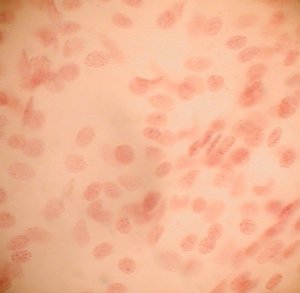
| L'amnios de l'embryon est prélevé et étalé en une couche monocellulaire, sur une lame de verre. | Une coloration à l'orcéine acétique (très concentrée) est pratiquée. | Aspect microscopique de la préparation précédente (moyen grossissement). Seuls les noyaux sont visibles, l'acide ayant détruit le cytoplasme. | Aspect microscopique (fort grossissement) de cellules amniotiques dont certaines présentent un corpuscule de Barr visible. |
Afin de limiter le volume d'embryon à couper pour la réalisation
des lames histologiques, seule une partie de l'embryon sera conservée
(tête et thorax seront éliminés). Une dissection partielle
de ce dernier est également effectuée. La cavité abdominale
est ouverte, le tube digestif est ôté, et l'appareil génital
apparaît. Dans le cas où l'âge de l'embryon correspond
à une différenciation suffisante de l'appareil génital
pour définir son sexe, il n'est pas nécessaire de faire un
test d'hétérochromatine sexuelle pour déterminer les
embryons à garder (un embryon de chaque sexe pour chaque stade).
 |
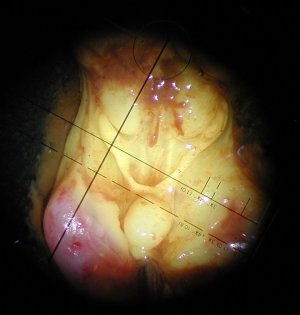 |
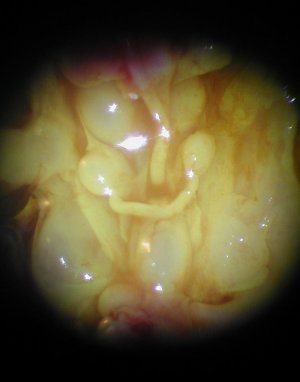 |
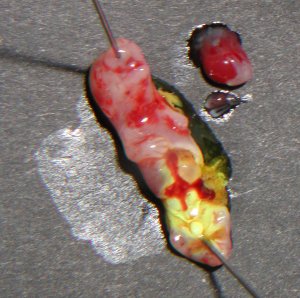
| Embryon de souris de 15 jpc, partiellement disséqué. L'appareil génital apparaît, vivement coloré en jaune par une goutte de fixateur (liquide de Bouin). | Aspect à la loupe binoculaire d'une partie de l'appareil génital d'un embryon souris femelle de 15 jpc. Les reins (métanéphros) forment deux masse ovoïdes qui cachent partiellement les ovaires (petits et de forme allongée), plaqués contre la partie haute des canaux de Müller. La vessie est visible en bas de l'abdomen. | Aspect à la loupe binoculaire d'une partie de l'appareil génital d'un embryon souris mâle de 15 jpc. On observe d'avant en arrière : les deux reins en position haute, les deux testicules en position moyenne et la vessie en position basse. Les canaux de Wolff (futurs déférents) sont visibles également. |
Fabrication de lames histologiques
L'étude de la différenciation histologique de la gonade se fera sur des lames à la paraffine, colorées par la méthode de Tuchmann-Duplessis. La différenciation de la gonade, dans son aspect fonctionnel, peut se faire par la mise en évidence de divers types de molécules comme l'AMH (hormone anti-Müllérienne) ou la BHSD (3bêta-hydroxystéroide-déshydrogénase, enzyme impliquée dans la synthèse des stéroïdes). Ces réactions histo-immunologiques et histo-chimique peuvent se faire sur des coupes de tissu congelé, conservant en particulier les lipides présents dans les cellules (qui disparaissent lorsqu'on utilise un fixateur à base d'alcool pour déshydrater le tissu).
Lames à la paraffine
 |
 |
 |
| Les organes prélevés (ovaires à gauche et testicules à droite) sont fixés par un bain dans le liquide de Bouin. | Le tissu (coloré par de l'éosine afin de faciliter son suivi pour les petites pièces) est inclus dans de la paraffine chaude. | Le bloc de paraffine contenant la pièce histologique est fixé sur le bras mobile du microtome. Ce bras s'abaissera sur le couteau, créant, à chaque mouvement, et par une avance progressive, une coupe de 10 micomètres d'épaisseur. |
Lames à congélation
 |
 |
 |
 |
| La pièce à couper est placée dans un bain de tampon additionné de fixateur peu concentré (formaldéhyde à 2%). | Elle est ensuite déposée sur le porte-objet dont la surface est recouverte d'un gel qui durcit avec le froid. | Vue d'ensemble du microtome à congélation dans son enceinte froide (- 20°C). On aperçoit les porte-objets en attente, sur le côté gauche de l'image. | Le fonctionnement de l'appareil est identique à un microtome classique. Les coupes successives forment un ruban, que l'on voit ici collé sur le couteau. |
 |
 |
 |
 |
| Un dispositif "anti-roll" empêche que les coupes ne se roulent sur elles-mêmes lors de la section. Il s'agit d'un bloc de plexiglas plan, en appui sur le couteau lors du fonctionnement. | La récupération d'un ruban de coupes peut de faire directement sur une lame de verre à température ambiante. Les coupes froides se collent spontanément dessus en décongelant. | Dans le cas où les coupes doivent faire l'objet d'une étude histo-chimique impliquant la mise en contact avec des solutions, les coupes sont récupérées une par une sur une lame à puits. | La lame obtenue est placée sur une plaque chauffante afin de parfaire le collage des coupes sur le verre. |
Images microscopiques et interprétations
des coupes histologiques