Glossaire
Histoire
Téléchargements
" Le sexe femelle est le sexe par défaut"
Mise au point récente (février 2003) de Corinne Cotinot, Solange Magre et Bernard Vigier
En 1947, Alfred Jost a montré que l'ablation des gonades sur un ftus de lapin entraînait le développement des voies génitales internes et des organes génitaux externes de type femelle, quelque soit le sexe génétique du ftus, XX ou XY. Ces expériences ont montré que la différenciation de ces organes dans le sens masculin dépend de la présence de testicules. Elles ont aussi donné naissance à l'hypothèse selon laquelle le développement femelle était l'état par défaut puisque la présence de gonades n'est pas nécessaire pour différencier un appareil externe femelle à la naissance. Cela ne veut donc absolument pas dire que l'ovaire se différencie spontanément en absence de chromosome Y car chez la plupart des mammifères (exception faite de la souris) les individus XO n'ont pas d'ovaires mais une bandelette fibreuse vide d'ovocytes et seront incapables de se reproduire. La présence de deux chromosomes X est indispensable à la différenciation ovarienne et la présence d'hormones femelles (oestrogènes, progestérone) produites par l'ovaire sera nécessaire au développement des caractères sexuels secondaires femelles à la puberté et à la fertilité des individus.
Différenciation ovarienne chez les mammifères
La formation puis la différenciation des follicules chez les mammifères débutent au cours du développement embryonnaire, et s'achève après la naissance (Fig. 1).Figure 1
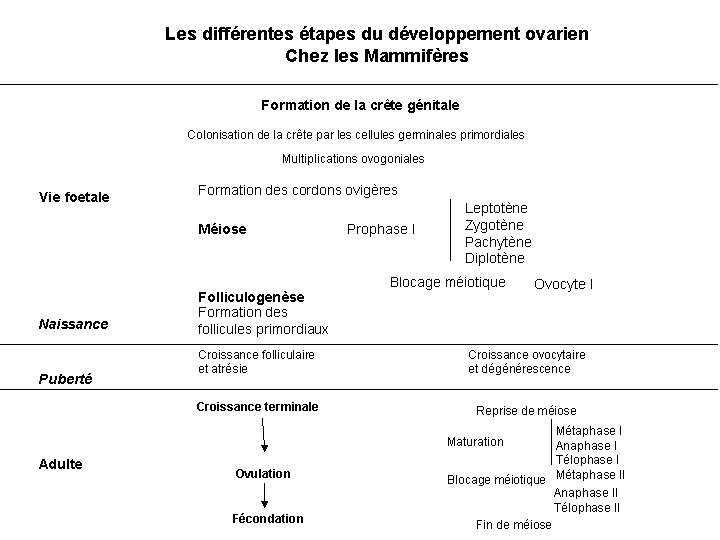
Plusieurs événements cruciaux de la différenciation ovarienne ont lieu pendant la vie ftale ou juste après la naissance selon les espèces (Fig. 2): l'organogenèse des ébauches gonadiques, l'entrée en méiose des ovogonies puis leur blocage en fin de prophase I, la formation du stock des follicules primordiaux et la différenciation jusqu'au stade de jeunes follicules à antrum (follicules tertiaires) (Fig. 2, 3, 4).
Figure 2
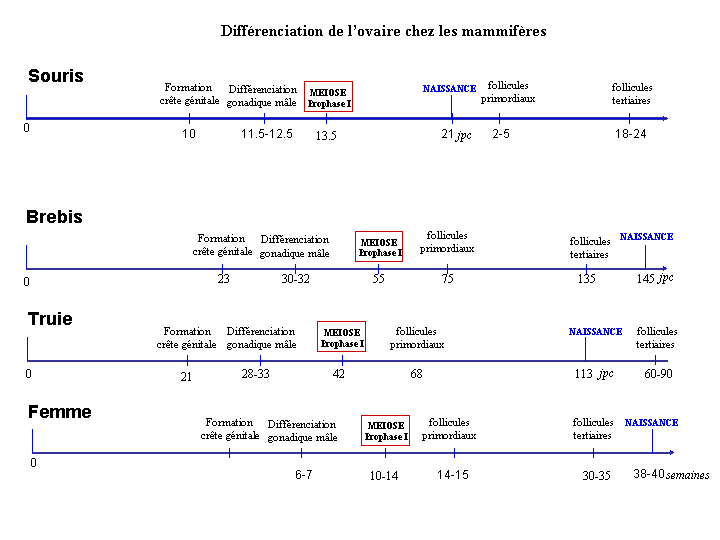
Figure 3:
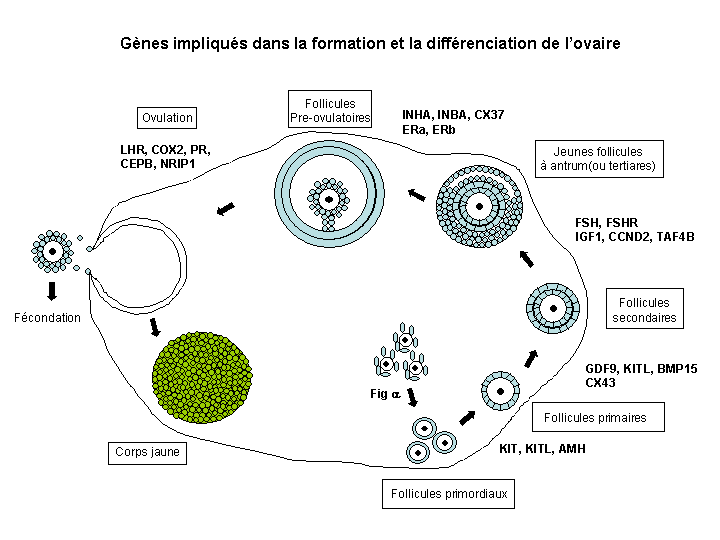
Il est difficile d'étudier les premières étapes de ce processus car il faut expérimenter sur des ftus et la taille des gonades à ces stades est extrêmement réduite. C'est sans doute pour ces raisons et par l'absence de modèles adéquats que peu de gènes impliqués spécifiquement dans le développement de l'ovaire de mammifère sont connus à ce jour. Cependant ces premières étapes sont déterminantes pour assurer la fonction de reproduction et il existe chez la femme comme chez l'animal des maladies génétiques conduisant à des dysgénésies gonadiques (complètes ou incomplètes), des infertilités ainsi que des inversions sexuelles qui sont dues au déroulement anormal de ces étapes initiales.
Les ébauches gonadiques mâles et femelles sont colonisées
très précocement par les cellules germinales primordiales,
et celles-ci continuent de proliférer par mitose. Puis uniquement
dans l'ovaire ftal, à un stade déterminé pour chaque
espèce, les ovogonies entrent en prophase I de méiose. Elles
progressent jusqu'au stade diplotène puis s'arrêtent (stade
dictyé). Plusieurs gènes sont connus pour participer à
ce mécanisme, il s'agit des gènes Msh4, Msh5, Dmc1, Atm,
et Spo11. L'inactivation par recombinaison homologue (knock-out) ou des
mutations dans ces gènes entraînent une perte massive d'ovocytes
et donc une stérilité.
Une des différences qui existe entre ovaire et testicule est
que l'ovaire ne peut se développer en l'absence de cellules germinales
à l'inverse du testicule. La présence d'ovocytes est nécessaire
à la différenciation et au maintien de l'ovaire.
Certains facteurs semblent intervenir dans la migration et la maintenance
des cellules germinales (ovogonies), il s'agit des facteurs codés
par les gènes KIT, Dazla, Boule, et Zfx.
La différenciation des différents types de cellules somatiques de l'ovaire est également contrôlé génétiquement, le facteur Wnt4 prévient la différenciation de cellules stéroidogènes de type mâle (Leydig) dans l'ovaire, la protéine FoxL2 empêche la différenciation de cellules de Sertoli et participe à la différenciation des cellules folliculaires. Ces deux gènes lorsqu'ils sont inactivés soit par recombinaison homologue (souris Wnt4-/-) soit par l'existence de mutations naturelles (chèvres PIS-/-) sont responsables de phénomène d'inversion sexuelle (XX mâle). Dans certaines espèces, comme les ruminants, le gène FoxL2 pourrait représenter l'équivalent du gène Sox9 (déterminant majeur de la différenciation testiculaire) pour l'ovaire et participer au contrôle de la différenciation ovarienne.
Ensuite, au cours de la 2ème moitié de la gestation ou juste après la naissance, selon les espèces, les follicules primordiaux vont se former au sein des ovaires ftaux (Fig. 4) à la suite de la fragmentation des cordons ovigères. Les ponts cytoplasmiques qui résultaient de la cytokinèse incomplète des cellules germinales vont se rompre et des cellules pré-granulosa vont progressivement entourer individuellement chaque ovocyte. Une apoptose massive des ovocytes va alors avoir lieu. Les cellules germinales survivantes qui sont bloquées en prophase I de division méiotique deviennent alors entourées par une monocouche de cellules folliculaires (Fig. 4).
Figure 4

Ces structures appelées follicules primordiaux représentent la réserve de follicules dont la femelle disposera durant toute sa vie reproductive. Un facteur dérivé de l'ovocyte, dénommé Figa semble indispensable à la formation des primordiaux car lorsqu'il est absent chez des souris Figa -/-, les follicules primordiaux ne se forment pas. Ensuite plusieurs facteurs sont impliqués dans la progression et la croissance des follicules. Il s'agit du facteur KIT, un récepteur à tyrosine kinase synthétisé par l'ovocyte, et de KITL son ligand présent à la surface des cellules folliculaires. Les souris présentant naturellement des mutations dans KITL peuvent former des follicules primordiaux mais ceux-ci sont ensuite incapables d'atteindre le stade de follicules primaires. Toutes ces étapes initiales de la formation puis de la progression des follicules jusqu'au stade secondaire se déroulent indépendamment des gonadotrophines hypophysaires qui ne sont pas encore produites et ce sont des facteurs paracrines intraovariens qui sont impliqués. Parmi ceux-ci, trois sont des membres de la super famille des TGF-b (transforming growth facteur-beta) : l'AMH (Anti-Mullérienne Hormone) qui semble impliquée dans le recrutement des follicules primordiaux vers les phases suivantes ; GDF9 (Growth différentiation factor 9) qui est impliqué dans la progression au delà du stade primaire et BMP15 (Bone Morphogenetic Protein 15) qui affecte la prolifération des cellules folliculaires. Des mutations homozygotes de ce gène chez la brebis entraînent un développement folliculaire incomplet bloqué après le stade follicule primaire.
Les connexines, protéines nécessaires à la formation
de gap jonctions, sont indispensables à la progression entre les
stades primaires et secondaires car les souris mutantes déficientes
en Cx43 (Cx43 -/-) sont dépourvues de follicules au delà
du stade primaire. Cette molécule est également nécessaire
plus tard dans la différenciation des follicules pré-ovulatoires.
C'est à la puberté, lors de la mise en route des cycles
(menstruels ou oestriens) et du système hormonal de l'axe hypothalamo-hypophysaire
que les follicules formés pendant la vie ftale ou les 1er jours
de vie vont achever leur croissance et différenciation terminale
et ovuler (soit chez la femme jusqu'à plus de 40 ans après).
Le reste du follicule dans l'ovaire se transformera alors en corps jaune.
Les approches de recherche systématique de nouveaux transcrits
exprimés dans l'ovaire en développement et le séquençage
systématique des génomes humains et d'animaux (souris, bovin,
porcin, etc..) ont déjà permis et vont permettre d'isoler
de nouveaux facteurs ovariens dont le rôle physiologique devra être
ensuite précisé et intégré aux connaissances
existantes.