- Découvrir les conséquences d'une mutation : la drépanocytose
1 - Pourquoi cette désoxyhémoglobine se polymérise-t-elle au point de former des fibres responsables de la déformation des hématies ?
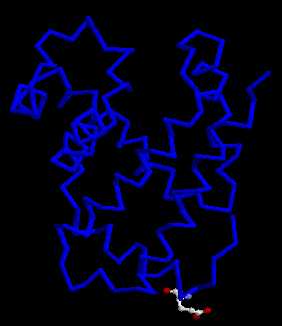
L'hypothèse la plus immédiate est que le remplacement de l'acide glutamique par la valine a pour conséquence de modifier la structure de la globine bêta et, peut-être, celle de l'hémoglobine. On propose de comparer les deux globines bêta (la globine normale et celle du sujet malade).
Résultats : l'hypothèse est-elle validée?
Objectifs Actions Comparer la globine bêta du sujet sain à celle du sujet atteint de drépanocytose
- 1er solution : comparaison par multifenêtrage
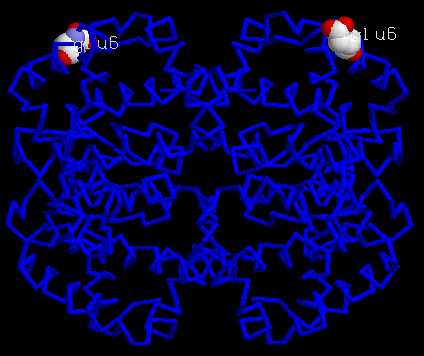
- 2ème solution : comparaison par superposition des 2 modèles dans la même fenêtre ...
Visualiser les modèles en rubans
Fichier
Ouvrir
Choisir betabnorm.pdb
Fichier
Ouvrir
Choisir betadrep.pdb
Fichier
Ouvrir
Choisir betabnorm.pdb
Fichier
Ajouter
Choisir betadrep.pdbRubans
AfficherVisualiser le 6ième résidu
Activer l'icône 
Ecrire glu6 (pour globnorm.pdb) ou val6 (pour globdrep.pdb)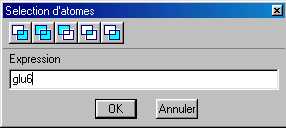
Activer l'icône
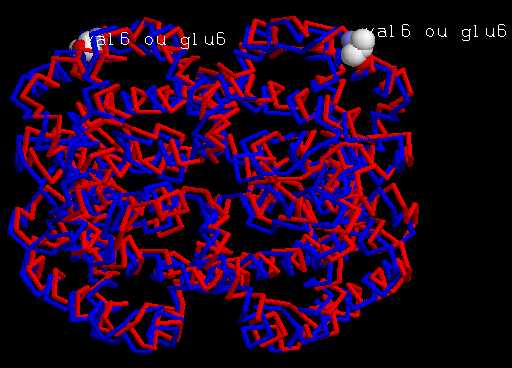
Une autre hypothèse est que le remplacement de l'acide glutamique par la valine a pour conséquence de modifier la structure de l'hémoglobine S. On propose de comparer les deux hémoglobines (l'hémoglobine A et l'hémoglobine S du sujet malade).
Résultat : Tirer un bilan de la recherche en précisant si l’hypothèse est validée ou non.
Objectifs Actions Comparer les deux hémoglobines.
Fichier
Fermer
Fichier
Ouvrir
Choisir hbnred.pdb
Fichier
Ajouter
Choisir hbsred.pdbAfficher Rubans
Activer l'icône

Ecrire glu6 (pour globnorm.pdb) ou val6 (pour globdrep.pdb)Sélectionner l'icône
2 - Quel rôle la valine n° 6 joue-t-elle dans la polymérisation de l’hémoglobine ?
On visualise un extrait du précipité fibreux d’hémoglobine S isolé à partir d'une hématie falciforme. On cherche à comprendre le mécanisme responsable de la polymérisation et donc de la déformation de l'hématie.
Résultats : Pour conclure, récapituler le mécanisme moléculaire à l’origine des anomalies cytologiques et physiologiques créées par cette mutation.
Objectifs Actions Voir deux molécules d’hémoglobine sicklémique prélevées dans un précipité fibreux de polydésoxyhémoglobine S d’une hématie falciforme.
Fichier
Fermer
Fichier
Ouvrir
Choisir hbshbs.pdbAfficher Rubans
Localiser la valine n°6 : activer l'icône

Ecrire val6
Sélectionner
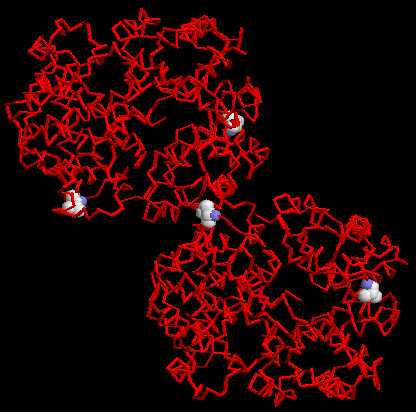
Deux molécules d’hémoglobine sicklémique
prélevées dans un précipité fibreux de polydésoxyhémoglobine S
d’une hématie falciforme. Affichage en rubans.