Etat
de l'art |
l'APP non pathogène(APP 695)
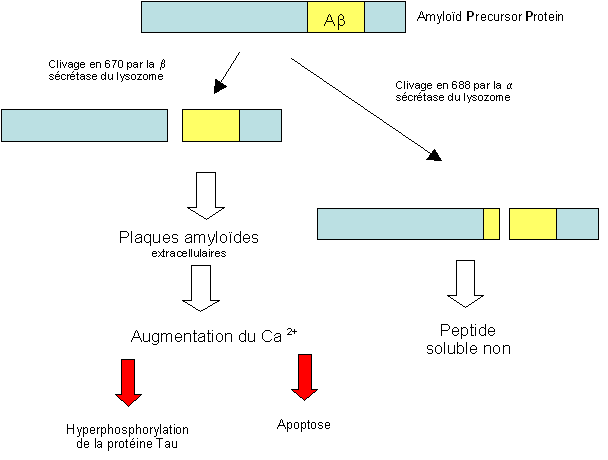
Les enzymes responsables de la coupure de l'APP en peptide amyloïde bêta sont des protéinases qui clivent l'APP, dont les mieux étudiées sont les sécrétases.
Les sécrétases produisent un fragment peptidique soluble renfermant seulement une partie du peptide pathogène Ab.
Dans un cerveau non malade, l'APP est coupée presque exclusivement par la sécrétase a (à un niveau voisin du segment de la bêta amyloïde): cette coupure protéique donne naissance à un peptide qui est soluble et qui donc ne donnera pas de plaques amyloïdes.
Dans les conditions physiologiques, il n'y a pas formation de la bêta amyloïde libre.
L'APP est sécrétée dans le milieu extracellulaire par la plupart des cellules et ses rôles sont multiples :- une séquence d'amino-acides de l'APP se lie avec l'héparine et les héparines sulfates protéoglycanes.
- Une liaison du même type s'effectue avec la matrice extracellulaire et permet la régulation de la croissance, de la différenciation cellulaire et la modulation de l'adhésion entre les cellules.
- Rôle dans la formation du cytosquelette et dans la formation des synapses tout comme dans la plasticité neuronale et la neurotransmission en particulier pour le système cholinergique
- Elle est également sécrétée pour protéger le neurone contre le stress oxydatif
- Elle possède une partie intracellulaire qui interagirait avec les protéines Tau.