Glossaire
Les insecticides OP et les carbamates ont pour cible l'enzyme acétylcholine estérase (Ace, présente au niveau des synapses cholinergiques et ayant pour rôle l'hydrolyse du neuromédiateur acétylcholine) qu'ils inhibent. Les anomalies de fonctionnement du système nerveux qui en résultent entraînent la mort de l'insecte sensible.Les mécanismes de la résistance des moustiques
aux insecticides OP et aux carbamates
Cependant, pour qu'un insecticide soit efficace il faut qu'il puisse atteindre sa cible, c'est à dire ici l'espace synaptique. Il doit donc pénétrer dans l'organisme de l'insecte et circuler dans son milieu intérieur.
La résistance aux insecticides OP et aux carbamates peut donc s'expliquer par des mécanismes qui empêchent ces insecticides d'atteindre leur cible, ou par une sensibilité moindre de la cible (Ace).
1 - Les mécanismes qui empêchent les insecticides d'atteindre leur cibleLes mécanismes qui empêchent les insecticides d'atteindre leur cible Les mécanismes qui rendent la cible moins sensible à l'insecticide
a) Rôle des estérasesa) Rôle des estérases b) Mise en évidence d'une production accrue d'estérases chez les moustiques résistants c) Localisation de la production d'estérases chez les moustiques résistants
Les estérases sont des enzymes naturellement produites par les insectes ; elles hydrolysent les liaisons ester, notamment celles des molécules des insecticides OP ; en revanche, elles sont sans action sur les carbamates (comme le propoxur). Il existe chez le moustique 2 sortes d'estérases appelées A et B.
Molécule de parathion, insecticide OP très toxique :
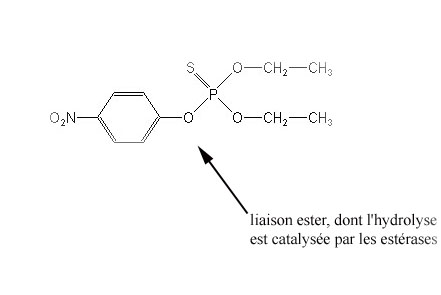
Cette action permet d'empêcher l'insecticide de pénétrer et de circuler dans l'organisme de l'insecte, donc d'atteindre sa cible. Il s'agit ici d'un mécanisme de détoxication par métabolisation de l'insecticide.
(le rôle physiologique des estérases est inconnu actuellement et elles ne semblent pas indispensables à la survie de l'insecte en milieu sans insecticide).
b) Mise en évidence d'une production accrue d'estérases chez les moustiques résistantsLa quantité d'estérases produite par un moustique peut
être évaluée par le test au papier filtre :
Principe du protocole expérimental appliqué à
la population de moustiques de la région de Montpellier (comprenant
des moustiques résistants et sensibles aux insecticides) : on écrase
des moustiques recueillis sur un papier filtre, puis on ajoute les réactifs
suivants :
Réalisation du test au laboratoire Le substrat chromogène est un mélange
de alpha-naphthyl acetate (alpha NA) et de beta-naphthyl acetate (bêta
NA). A la rigueur, un seul des 2 peut être utilisé, mais habituellement,
c'est un mélange des 2, dans un rapport 1:1.
|
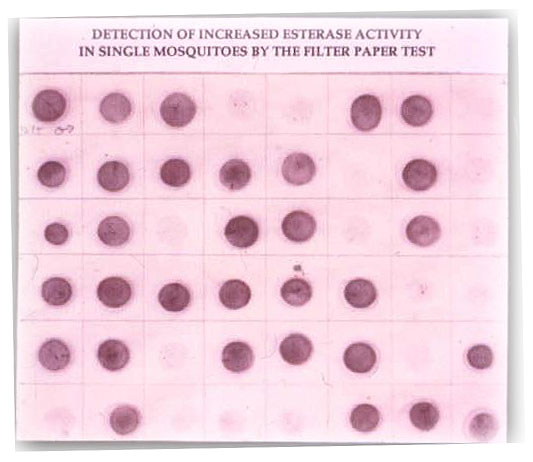 |
La production d'estérases par les moustiques sensibles est très
faible, insuffisante pour empêcher l'insecticide d'agir. Chez certaines
souches
résistantes, la production d'estérases en beaucoup plus grande
quantité est le mécanisme à l'origine de la résistance.
Il ne s'agit donc pas d'un changement qualitatif (effficacité des
estérases) mais d'un changement quantitatif (l'augmentation de la
quantité d'estérases produites peut être considérable,
jusqu'à représenter 6 à 10 % des protéines
totales de l'insecte).
Les estérases peuvent être mises en évidence par une technique d'immunofluorescence.
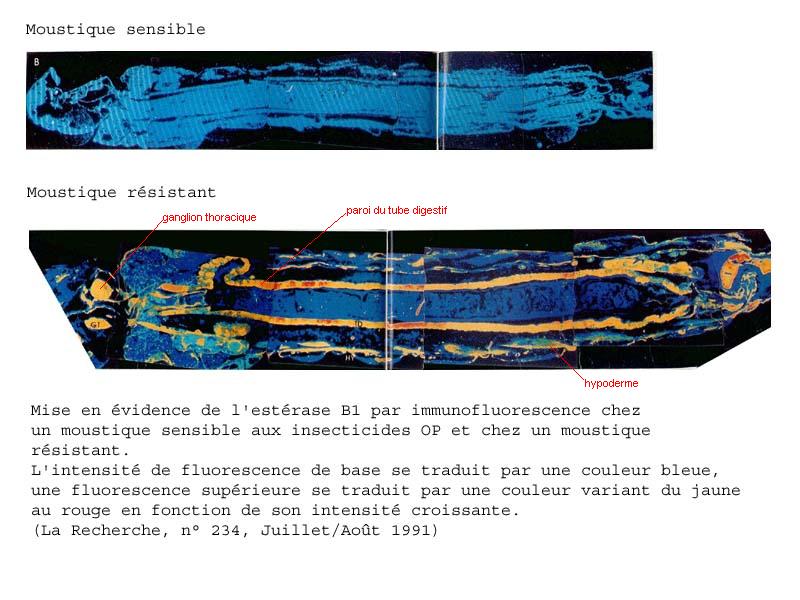
Les gènes codant pour les estérases ne s'expriment pas dans tous les tissus de l'insecte ; cette expression a surtout lieu dans la paroi du tube digestif, la zone cellulaire cutanée sous-hypodermique et les ganglions cérébraux et thoraciques, les deux premiers tissus constituant les principales voies de pénétration de l'insecticide dans l'organisme, les derniers contenant la cible des insecticides.
2 - Les mécanismes qui rendent la cible moins sensible à l'insecticide : les mutations de l'acétylcholinestérase (ACE)Certains moustiques doivent leur résistance aux insecticides OP et aux carbamates à un changement de la structure spatiale de leurs molécules d'Ace, cible des insecticides, changement qui insensibilise l'Ace à l'action de ces insecticides.
Les différences dans les propriétés de l'Ace de moustiques présentant cette forme de résistance et de moustiques sensibles peuvent être détectées par le test suivant :
- protocole expérimental :
- on broie le moustique (ou la larve) et le broyat est homogénéisé dans un tube Eppendorf avec une solution tampon (20 mM tris, pH 7, contenant 1% de Triton X-100). Après centrifugation à 10 000g pendant 2 mn, le surnageant (qui contient l'ACE) est recueilli et réparti dans les puits d'une plaque (100 microlitres dans chaque puits),
- on ajoute alors dans chaque puits soit 10 microlitres d'une solution concentrée d'insecticide (solution de propoxur à 10-2 M), puits B, soit 10 microlitres d'alcool, puits A. La plaque est laissée pendant 15 mn à température ambiante (ce temps est suffisant pour permettre l'action éventuelle de l'insecticide),
- détermination de l'activité catalytique de l'ACE : on ajoute dans chaque puits 100 microlitres d'une solution contenant de l'acétylcholine (2,5 mM) et 0,2 mM de DTNB (dinitro-2-benzoic). On évalue l'intensité de la coloration par mesure de densité optique (la densité optique augmente en fonction de la coloration) : si l'enzyme est active, les produits de l'hydrolyse de l'acétylcholine réagissent avec le DTNB pour donner une substance qui présente un pic d'absorption pour des radiations de 412 nm. On peut donc suivre le déroulement de la réaction par spectrophotométrie. Les graphes ci-dessous traduisent l'évolution de la densité optique pendant 10 mn dans chaque puits, pour 8 moustiques sensibles et 8 moustiques résistants (en ordonnée : intensité de la densité optique; en abscisse :le temps) :
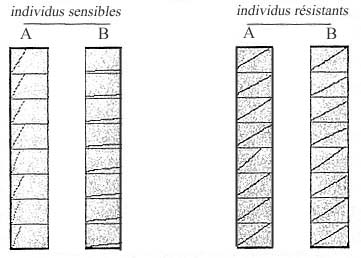
- analyse des résultats pour les moustiques sensibles : par rapport aux puits témoins (A), l'évolution de la densité optique des puits où l'on a ajouté de l'insecticide (B) est quasi nulle (ligne presque horizontale). L'Ace a donc été inactivée par l'insecticide.
- analyse des résultats pour les moustiques résistants : la pente des courbes traduisant l'évolution de la densité optique est la même dans les puits avec ou sans insecticide. On peut donc en conclure que l'ACE des moustiques résistants est totalement insensible au propoxur. D'autre part, la pente de la droite traduisant l'évolution de la densité optique en absence d'insecticide est nettement plus faible chez les moustiques résistants que chez les moustiques sensibles. L'Ace des moustiques résistants est donc moins active, moins efficace, que celle des moustiques sensibles. La réduction d'activité de l'enzyme résistante par rapport à l'enzyme sensible est d'environ 60 %. C'est un aspect du coût de la résistance.