Glossaire
Histoire
Téléchargement
Rédigé par Jean-Pierre Ternaux, Laboratoire de Neurocybernétique cellulaire - CNRS Marseille
I. Principe
L'acetylcholine (ACh) est le neurotransmetteur des jonctions neuromusculaires chez le mammifère. Chez l'animal adulte l'ACh est synthétisée au niveau des motoneurones spinaux et du tronc cérébral. La synthèse s'effectue dans les corps cellulaires et dans les terminaisons des axones moteurs, au niveau de l'effecteur musculaire. Les motoneurones ne sont pas les seuls neurones du système nerveux central qui possèdent l'ACh comme neurotransmetteurs. Des interneurones localisés au niveau du septum du striatum et du cortex sont eux aussi cholinergiques. Ces derniers semblent être principalement impliqués dans les mécanismes de dégénérescence qui caractérisent la maladie d'Alzheimer.
La choline acetyl transférase ( ChAT) qui catalyse la transformation de la choline en ACh , en présence d'un donneur de radical acetyl: l'acetyl Coenzyme A (ACoA), est une enzyme cytoplasmique, synthétisée au niveau du corps cellulaire des neurones cholinergiques et transportée par le flux axoplasmique, jusqu'au niveau des terminaisons axoniques.
Le motoneurone lui même et l'élément post synaptique de la jonction neuromusculaire synthétisent l'enzyme de dégradation de l'ACh: l'Acetylcholine estérase (AChE). Cette enzyme catabolique hydrolyse l'ACh libérée en choline et en acide acétique. L' AChE cytoplasmique peut être libérée par les terminaisons axoniques des motoneurones , elle est également présente sous forme fixée à la membrane du motoneurone et de l'effecteur musculaire. La choline qui résulte de l'hydrolyse de l'ACh par l'AChE est recaptée par les terminaisons axoniques des motoneurones (recapture à haute affinité) où elle sera utilisée, à nouveau, comme précurseur de l'acetylcholine.
Choline + ACoA ![]() ACh
ACh
ChAT
ACh ![]() Choline + Acide acétique
Choline + Acide acétique
AChE
Ces deux réactions existent donc au sein du motoneurone. La choline peut être transformée en bétaïne en présence de choline oxydase. Cette réaction s'accompagne de la formation d'une molécule d'eau oxygénée qui en présence d'une péroxydase et d'une molécule donneur de photons, comme le luminol , donnera naissance à une émission de lumière et à la production d'acide aminophtalique.
La mesure de l'ACh par
chimiluminescence est basée sur les réactions suivantes :
Réaction 1:Acétylcholine  choline
+ Acide acétique
choline
+ Acide acétique
AChE
AChE
Réaction 2: Choline Bétaïne
+ H2 O2
Bétaïne
+ H2 O2
Choline oxydase
Choline oxydase
Réaction 3: H2O2
+ Luminol hm
+ Acide Aminophtalique
hm
+ Acide Aminophtalique
Peroxydase
hm
: émission
de photons, lumière (avec le luminol, longueur d'onde de 450 nm)
Dans ces conditions,
la quantité de photons émis à la suite des trois réactions
est proportionnelle à la quantité d'ACh contenue dans l'échantillon
biologique.
II.
Méthodologie
La détection des
quantités d'ACh par chimiluminescence peut être éffectuée
sur des échantillons de tissus nerveux prélevés sur
des cerveaux frais adultes ou au cours du développement embryonnaire
ou post-natal, sur des cultures de cellules nerveuses, sur des cultures
de motoneurones purifiés ou sur des cultures organotypiques. Dans
ces conditions c'est le contenu endogène d'ACh qui est mesuré.
Le dosage de l'ACh peut être également effectué sur des perfusats, lorsqu'une structure cérébrale est perfusée par un liquide physiologique ou lorsque des cultures de neurones sont incubées en présence de liquide céphalo-rachidien artificiel. Dans ces conditions l'ACh mesurée correspond aux quantités libérées par les éléments cholinergiques présents dans le tissu ou dans les cultures. (voir également les méthodologies pour la mesure de la libération des neurotransmetteurs).
Le dosage de l'ACh peut être également effectué sur des perfusats, lorsqu'une structure cérébrale est perfusée par un liquide physiologique ou lorsque des cultures de neurones sont incubées en présence de liquide céphalo-rachidien artificiel. Dans ces conditions l'ACh mesurée correspond aux quantités libérées par les éléments cholinergiques présents dans le tissu ou dans les cultures. (voir également les méthodologies pour la mesure de la libération des neurotransmetteurs).
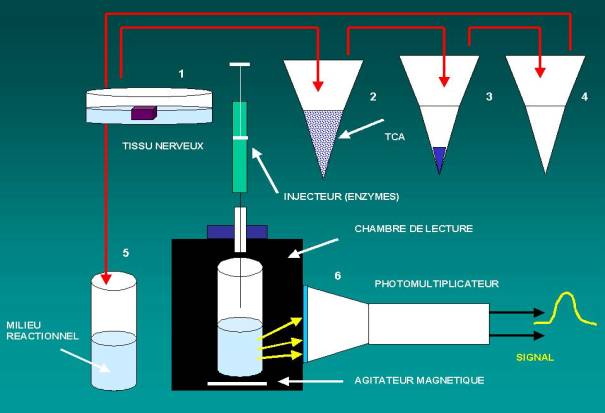
FIGURE 1. Le tissu nerveux est prélevé sur biopsies de cerveau maintenues dans un liquide physiologique à 4°C (1) ou à partir de cultures. Les prélèvements sont sectionnés en petits fragments d'environ 1 mm3 et transférés dans un microtube contenant 500 µl d'acide trichloracétique (2). Le liquide est soumis aux ultrasons pendant 10 secondes de façon à homogénéiser le tissu dans l'acide. Dans ces conditions toutes les protéines sont précipitées. Le tube est centrifugé de façon à obtenir un culot de protéines (3). La fraction soluble est prélevée et le pH de la solution est ramené à 7, 4 à l'aide de NaOH (4). 5O µL de la fraction soluble sont ajoutés au milieu réactionnel (500 µl) constitué d'un tampon phosphate Na/ Na2, (pH: 7,4) contenant du luminol et de la peroxydase (5). Le tube de milieu réactionnel est introduit dans la chambre de lecture d'un chimiluminomètre (6). Les injections d'enzymes peuvent être réalisées au travers d'un opercule à l'aide d'une micro-seringue. Les photons émis frappent la surface du photomultiplicateur qui transforme le signal photonique en un signal analogique.
A. Mesure du taux
endogène d'ACh.
Un prélèvement de tissu est effectué au niveau
du système nerveux central (quelques mg de tissu) ou les neurones
d'une culture sont détachés de leur support d'adhésion
par un traitement léger à la trypsine. Le tissu est récupéré
dans un micro tube contenant de l'acide trichloracétique. Le tissu
est homogénéisé par une sonde à ultrasons.
Dans ces conditions les protéines sont précipitées.
Une centrifugation permet de séparer le culot de protéines,
d'une phase soluble contenant, en autres, l' ACh, mais aussi son précurseur,
la choline, résultant de la dégradation par l'AchE (voir
réaction 1)
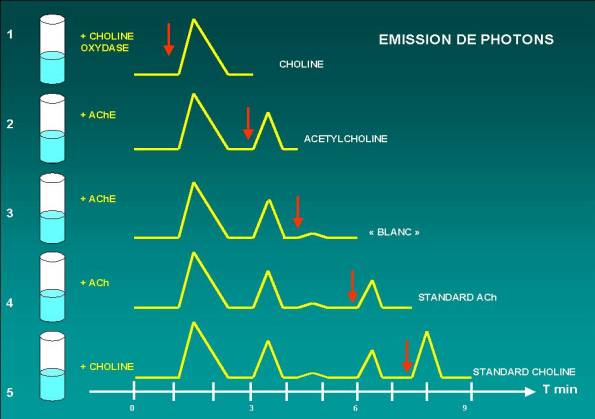
FIGURE 2. Evolution de l'émission de photons au cours du temps. 1: l'injection de choline oxydase dans le milieu réactionnel induit la formation d'eau oxygénée et de bétaine (réaction 2), une émission de photons résultant de l'oxydation du luminol est alors instantanément induite (réaction 3). Lorsque la choline de l'échantillon est totalement oxydée, le tracé retourne à son niveau de base. 2: l'injection d'AChE dans le milieu réactionnel provoque alors le déclenchement des trois réactions successives, conduisant à l'émission d'un pic de lumière qui correspond à l'hydrolyse de l'ACh. 3: une nouvelle injection d'AChE permet d'estimer la valeur du "blanc" du dosage. 4 et 5: des standards contenant des quantités connues d'ACh et de choline sont ensuite injectés de façon à calculer les quantités de ces deux substances présentes dans l'échantillon. La valeur du "blanc" est systématiquement retranchée à la surface des pics de lumière correspondant à l'ACh et à la choline.
Un milieu réactionnel est préparé dans un tampon phosphate de sodium, contenant respectivement : du luminol, et de la peroxydase. Un prélévement de 50 µL de la fraction soluble est introduit dans 500 µl du milieu réactionnel. Après homogénéisation, le tube est introduit dans la chambre d'un chimiluminomètre et la lumière est mesurée. Aucune variation de lumière n'est enregistrée puisque aucune des réactions enzymatiques n'est déclenchée. L'injection de Choline oxydase dans le tube induit la réaction 2 et la réaction 3. Dans ces conditions la choline présente dans l'échantillon est oxydée et une émission de lumière peut être enregistrée. Le pic de lumière enregistré correspond à la quantité de choline présente dans l'échantillon. Lorsque toute la choline a été oxydée, la lumière retourne à son niveau de base. A ce moment, l'injection d'AChE dans le milieu réactionnel induit l'enclenchement des réactions 1, 2 et 3. Un nouveau pic de lumière est enregistré dont la surface est proportionnelle à la quantité d'ACh présente dans l'échantillon. Après retour à la ligne de base, une nouvelle injection d'AChE est réalisée de façon à vérifier que toute l' ACh présente dans l'échantillon a été hydrolysée. Cette injection provoque l'émission d'un petit pic de lumière appelé "Blanc" du dosage qui est dû essentiellement à la présence d'impuretés dans les préparations enzymatiques utilisées, malgré leur purification. Enfin, l'injection d'une quantité connue d'ACh dans le milieu réactionnel permet d'estimer la surface du pic de lumière et de calculer la quantité d'ACh présente dans l'échantillon. Les valeurs correspondantes au "Blanc" du dosage sont soustraites aux surfaces des pics obtenu pour l'échantillon dosé et pour les standards d'ACh. Des standards de choline peuvent être également introduits dans le milieu réactionnel pour estimer la quantité de choline présente dans l'échantillon.
La sensibilité de ce dosage de l'ACh par chimiluminescence est de l'ordre de quelque picogrammes.
B. Mesure de l'ACh Libérée
Le
principe de la mesure est identique. Les échantillons sont constitués
par du liquide physiologique (liquide céphalo-rachidien artificiel)
provenant soit de la perfusion d'une structure cérébrale
(cupule, push-pull canule, perfusion ventriculaire, tube à dialyse…)
ou de l'incubation ou de la perfusion d'une culture de neurones.
C. Instrumentation
La
lumière émise par les réactions enzymatiques est détectée
à l'aide d'un photomultiplicateur placé devant le tube contenant
le milieu réactionnel. Ce dernier est placé dans une chambre
noire, à l'abri de toute lumière et les injections d'enzyme
sont réalisées au travers d'un opercule pour éviter
toute propagation de photons provenant du milieu environnant. Le photomultiplicateur
transforme le signal photonique en signal analogique. Le photomultiplicateur
est relié à un enregistreur qui permet d'enregistrer, en
fonction du temps, le décours des variations de potentiel. Parallèlement
un intégrateur permet de calculer la surface des pics de lumière
obtenus.
D. Applications des techniques de chimi et de bioluminescence au dosage d'autres molécules
Les
techniques de chimi et de bioluminescence (ces dernières utilisent
des donneurs de photons issus d'organismes biologiques comme le système
luciférine luciférase du ver luisant) sont applicables pour
mesurer les quantités endogènes et libérées
de diverses substances comme le glucose (utilisation d'une glucose oxydase),
l'ATP, mais aussi d'autres neurotransmetteurs comme le Glutamate et le
GABA. Ces méthodes de dosage peuvent être également
adaptées pour visualiser la présence de ces substances dans
des tissus vivants (caméra CCD ultrasensibles refroidies) ou pour
identifier l'expression de certains gènes au niveau cellulaire (insertion
du gène codant pour la luciférase et utilisation de la luciférine
comme substrat). Ces méthodes sont extrêmement sensibles et
tendent à se substituer à l'utilisation des techniques isotopiques
(utilisation de radioéléments) qui nécessitent la
mise en œuvre de règles contraignantes de radioprotection et une
élimination contrôlée des déchets radioactifs.