
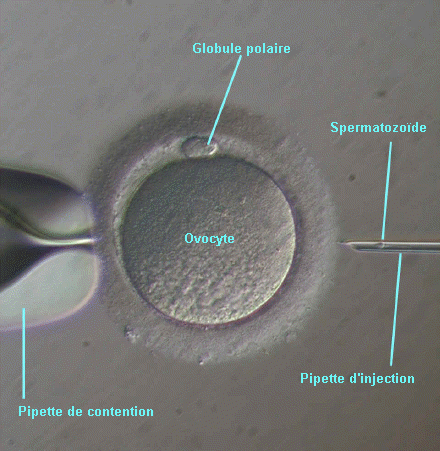
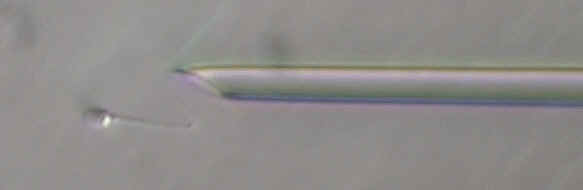

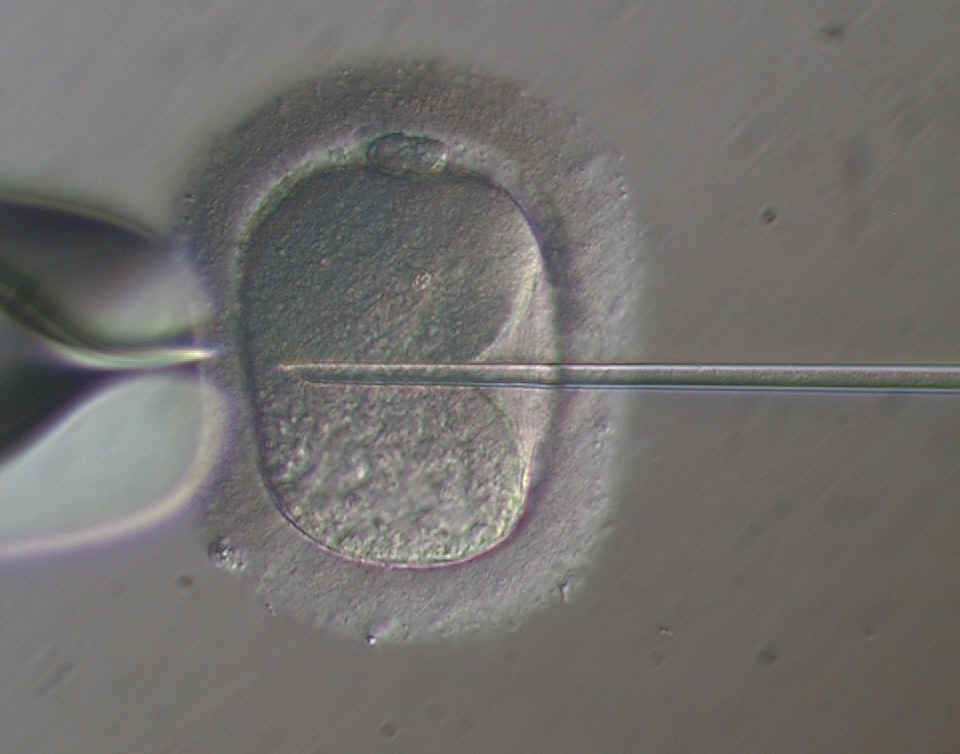
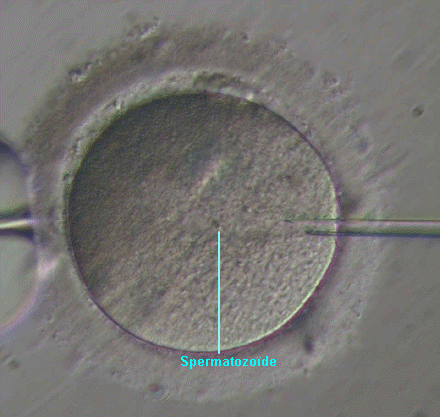
- l'article "Les techniques biologiques en fécondation in vitro", de Jean-François Guérin, paru dans Médecine-thérapeutique, Endocrinologie et reproduction, vol.5; n°1, janvier-mars 2003
- l'article "Les protocoles de stimulation ovarienne en vue de fécondation in vitro: évolution au cours des dernières années. Qu'en est-il en 2003?" de Jean-Noël Hugues,Viriak Kattygnarath et Isabelle Cédrin-Dumérin, paru dans Médecine-thérapeutique, Endocrinologie et reproduction, vol.5; n°1, janvier-mars 2003
-le livre "Les bébés de l'espoir", de Joëlle Belaïtsch-Allart et Michelle Plachot, édition ESKA, juillet 2001
La première naissance d'un enfant issu de fécondation
in vitro, Louise Brown, date de 1978, et est due à l'équipe
anglaise de Streptoe et Edwards.Cette naissance (le 75ème être
vivant conçu de cette façon, après quelques souris,
rats et lapins..) fut entourée d'incrédulité et ces
chercheurs furent, à l'époque, qualifiés "d'apprentis
sorciers"; une conception non naturelle et en dehors de l'organisme ne
pouvait engendrer que des enfants anormaux...
En France, ce n'est qu'en 1982 que naquit Amandine, bébé
"éprouvette".
Vers la fin des années 80, un grand nombre de centres étaient
crées en France et on comptait alors environ 20 000 tentatives de
FIV par an.
Malgré l'instauration de l'agrémentation obligatoire
et renouvelable de ces centres (loi de bioéthique de 1994), le nombre
de tentatives a doublé depuis 1998: on compte aujourd'hui environ
40 000 tentatives annuelles (données FIVNAT 2001).
Une analyse plus fine montre, après une période de stagnation,
une nette augmentation des FIV en France, depuis 1994, grâce à
l'apparition et au développement de la technique de micro-injection
intra-ovocytaire d'un spermatozoide, ou ICSI (intracytoplasmic sperm injection).
Parallèlement, les protocoles d'induction d'ovulation en vue
de recueil d'ovocytes ont évolué durant la dernière
décennie; visant, notamment, à diminuer les risques de complications
pour les patientes.
Rappels sur les différents types de stérilité
Rappels sur la technique de FIVconventionnelle
En présence d'une obstruction epididymaire, les spermatozoides
seront ponctionnés en amont de l'obstruction (dans le canal épididymaire)
et un gradient à deux couches suffira à les sélectionner.
Dans le cas d'une spermatogénèse anormale, on n'est pas
sûr de trouver des spermatozoides et les marqueurs comme le taux
de FSH ou d'inhibineB (FSH basse et inhibine élevée) ne sont
pas fiables. De plus on ne récupère, par biopsie, non pas
un fluide mais un parenchyme testiculaire dont il faut extraire des spermatozoides
peu nombreux et souvent immobiles. L'incubation du parenchyme permet de
récupérer davantage de spermatozoides, mais la proportion
de spermatozoides morts augmente aussi.
Les spermatozoides sont donc récupérés par dilacération
du parenchyme testiculaire avec des aiguilles. La centrifugation simple
mélangerait le peu de spermatozoides extraits avec d'autres cellules,
dans le culot. La meilleure technique consiste en une centrifugation sur
couche unique, de façon que les cellules soient arrêtées
en surface et que les spermatozoides se retrouvent dans une suspension
qui est ensuite lavée. La mobilité des spermatozoides, fort
dépendante de leur métabolisme
énergétique, peut ensuite, si nécessaire, être
initiée chimiquement (en utilisant un inhibiteur de la phosphodiestérase
pour augmenter le taux d'AMPc). Les spermatozoides ainsi préparés
peuvent êre congelés en attendant la ponction ovarienne.
Une des techniques permettant de palier à un faible taux de spermatozoides dans le sperme (oligospermie) consistait à placer l'ovocyte en culture dans un faible volume de milieu (une goutte de 20 microlitre) sous huile de paraffine. Le nombre de spermatozoides nécessaires à l'insémination n'étant plus alors que de quelques milliers (en respectant la fourchette de concentration déterminée pour la culture dans un plus large volume: de 50 000 à 100 000 spz mobiles pour 1ml). Ceci permettait la prise en charge d'hommes ayant un sperme très pauvre, mais donnait des résultats souvent décevants.
Grâce à l'ICSI, cette prise en charge s'est montrée très efficace. Elle le fut également pour les spermes pathologiques (tératospermies et asthénospermie).
La première grossesse obtenue par injection directe d'un spermatozoide dans le cytoplasme d'un ovocyte fut obtenue par Palermo et al, en 1992. Ce résultat fut accueilli avec scepticisme car il remettait en cause les théories sur la transduction du signal après piqure spermatique: on pensait que seule l'étape de fusion membranaire permettait une oscillation calcique responsable de l'activation de l'oeuf et de la formation de la membrane de fécondation par ouverture des granules corticaux. Ces oscillations calciques sont déclenchées en réalité par un facteur spermatique cytosolique, ce qui explique que le dépôt du spermatozoide au coeur du cytoplasme puisse entraîner l'activation ovocytaire.
 |
 |
 |
 |
 |
 |
| Résultats FIVNAT 2001, portant sur l'activité des centres français en l'an 2000 | FIVc | ICSI |
| % d'embryons par rapport au nombre d'ovocytes inséminés | 57,6 | 62,0 |
| % de transferts par rapports au nombre de ponctions | 83,2 | 92,5 |
| % de grossesse par rapport au nombre de transferts | 26,1 | 26,6 |
Cette technique est essentiellement indiquée dans le cas de succession d'échecs d'implantation à partir d'embryons de 4 cellules, frais ou décongelés.
Les cultures prolongées se font maintenant sur milieux séquentiels (de façon à imiter les changements naturels de milieu subi par l'embyon (environnement tubaire, puis utérin), et les co-cultures sur lignées cellulaires pérennisées ont été abandonnées, par principe de précaution, selon les recommandations du guide des "bonnes pratiques en AMP".
 |
 |
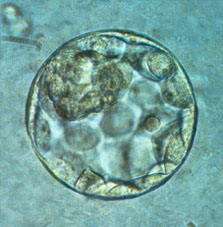
| Blastocyste humain de 5 jours.
http://www.cpma-ulg.be/physiologie.html |
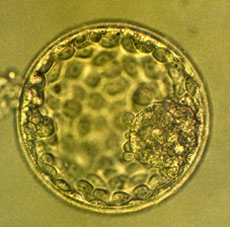
Blastocyste expansé.
http://www.cpma-ulg.be/physiologie.html |
 |
|
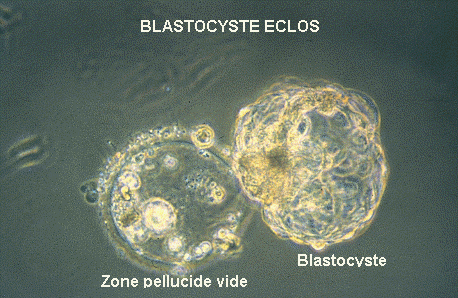
| L'éclosion du blastocyste a lieu in vivo, dans la
cavité utérine, 5 jours après la fécondation.
C'est sous l'effet de l'extension du blastocyste que la zone pellucide
se rompt, 6 jours après la féondation.
http://www.cite-sciences.fr |
|
En culture, seul un très faible pourcentage de blastocsytes éclot
spontanément (3%). Ceci laisse à penser que cette impossibilité
d'éclore peut constituer une cause majeure d'échec d'implantation.
Il semble en effet que les techniques de culture des embyons durcissent
la zone pellucide qui les entoure (cette ZP est naturellement durcie après
la fécondation, c'est l'expansion de l'embryon qui l'amincit, au
stade blastocyste avancé, ainsi que ses enzymes lytiques et celles
des sécrétions utérines).
L'éclosion assistée (EA) consiste à créer
une brèche dans la ZP et peut se faire de différentes façons;
mécanique, chimique ou physique (laser).
Cette technique permet une augmentation significative du taux d'éclosion
in vitro mais les conséquences en terme d'implantation des ovocytes
ainsi traités sont controversées.Cette technique est intéressante
dans le cas de ZP épaisses (cas rares) et est à l'étude
pour les embryons ayant été congelés, la cryoconservation
modifiant vraisemblablement la structue de la ZP.
Ces embryons peuvent être congelés et décongelés
(la première grossesse issue d'un embryon ayant subi ce type de
traitement a été rapportée en 1983) à condition
de respecter certains facteurs.
L'embryon doit être entouré d'un cryoprotecteur (les nouveaux
cryoprotecteurs sont le propane-diol et le sucrose)
La congélation doit se faire d'abord lentement jusqu'à
-30°C (baisse de 0,3°C par minute), avec induction de la cristallisation
à -7°C (les protocoles de congélation ultra-rapide, avec
vitrification, ne donnent pas de meilleurs résultats), puis refroidissement
rapide de -30°C à -150°C (baisse de 20°C par minute),
températre à laquelle ils sont plongées dans l'azote
liquide.
Lors de la décongélation, le réchauffement doit
être rapide, de façon à éviter la formation
de recristallisation. Les paillettes sont plongées à cet
effet dans un bain-marie à 37°C (ou simplement laissées
à température ambiante). Le cryoprotecteur doit être
ensuite rapidement éliminé (on passe les embryons dans des
milieux de plus en plus dilués) car il est particulièrement
toxique lors de cette étape.
La durée de cryoconservation ne semble pas influencer la viabilité
des embryons après décongélation, au moins en ce qui
concerne des périodes réalistes de stockage, inférieures
à 8 ans. Certains praticiens ne réimplantent ces embryons
que quelques heures après décongélation, afin de vérifier
qu'ils ont bien repris leur division, ce qui atteste de leur viabilité.
La réussite de la congélation dépend aussi et surtout
de l'embryon lui-même. Le stade optimal auquel l'embryon doit être
congelé est encore sujet à discussion. Le stade le plus classique
est "l'embryon clivé précoce", à 4 cellules (J2).
Chez les animaux, c'est le stade blastocyste qui est privilégié
pour les congélations, mais ce sont des blastocystes obtenus in
vivo. Les blastocystes obtenus in vitro sont plus fragiles, surtout depuis
que les milieux séquentiels ont remplacé les co-cultures.
Enfin il ne semble pas y avoir d'influence nette de la technique de
fécondation (FIVc ou ICSI) sur la qualité des embryons cryoconservés.
La réussite de la congélation dépend surtout de
la qualité embryonnaire initiale. A partir d'un certain degré
de fragmentation, les embryons supporteront mal la cryoconservation (les
fragments se lysent lors de la déongélation et entraînent
la lyse des blastomères voisins). On considère qu'un embryon
a bien résisté à la congélation s'il n'a perdu
que la moitié de ses blastomères après décongélation
(il faut qu'il lui reste au moins deux beaux blastomères dans un
embryon de 4 cellules pour qu'il se développe normalement).
Les résultats obtenus dans les années 80 avec une cryoconservation
utilisant le DMSO comme cryoprotecteur n'ont pas été bons.
Des techniques utilisant le propanediol sont au point actuellement. Elles
permettent de congeler des ovocytes au stade MII essentiellement. Le stade
MI, dit de la "vésicule germinative" est moins performant en terme
de résultat global (survie, maturation in vitro, fécondation,
développement et grossesse). La plupart des équipes congèlent
des ovocytes au stade de métaphase II (ce sont par exemple des ovocytes
non fécondés, après ICSI).
Les problèmes rencontrés viennent de l'impact de la congélation
sur le fuseau méiotique. Le refroidissement subi par l'ovocyte est
susceptible de dépolymériser les tubulines dont sont constitués
les filaments de ce fuseau. La conséquence est alors une dispersion
des chromosomes dans le cytoplasme et une aneuploïdie des embryons
issus de tels ovocytes.
De plus la congélation durcit la zone pellucide, ce qui rend
plus difficile ensuite la fécondation.
Cependant quelques grossesses ont été obtenues avec cette technique.
Les objectifs visés par les études sur ces protocoles concernent essentiellement une diminutin des risques de complication et une amélioration du confort général des patientes.
Les deux protocoles utilisés étaient dits courts ou longs.
Dans le protocole long, la désensibilisation de l'hypophyse
précède la stimulation de l'ovaire, une période d'application
d'agonistes du GnRH d'une quinzaine de jour provoque la désensibiliation
de l'hypophyse, ensuite l'adminisration conjointe de cet agoniste avec
les hormones de stimulation ovariennes (HMG+FSHr) entraine le développement
des follicules. Dès que plus de 3 d'entre eux ont atteint un diamètre
supérieur à 17mm (échographie) et que e taux d'oestraiol
circulan est suffisant, l'ovulation est déclenchée par une
administration d'HCG.
Dans le protocole court l'administration de l'agoniste du GnRH ne dure
que deux jours et dès le troisième, il est associé
au traitement de stimulation. Il y a alors combinaison de l'effet initial
du GnRH qui est de provoquer le libération par l'hypophyse des gonadotrophines
endogènes (effet flare-up), aux gonadotrophines exogènes
du traitement de stimulation. Ce protocole, plus puissant, est réservé
aux femmes de plus de 38 ans qui ont habituelement une réponse ovarienne
plus faible.
Il existe cependant de possibles effets délétères des agonistes du GnRH sur la fonction ovarienne (il a été découvert des récepteurs au GnRH dans les ovaires et des concentrations non négligeables de GnRH ont été mesurées dans le liquide folliculaire). D'autre part, il est bien établi que la stimulation ovarienne requiert des concentrations de gonadotrophines exogènes plus élevées lorsqu'il a été fait usage auparavant d'agonistes du GnRH.
Une réduction des doses d'agonistes semblait donc logique.
Elle a été appliquée aux protocoles longs et aux protocoles
courts.
En protocoles courts, l'utilisation de mini-doses d'agoniste du GnRH
a baissé l'effet flare-up qui est dose-dépendant mais les
réponses ovariennes aux gonadotrophines exogènes ont été
meilleures.
Ces molécules sont construites sur le même principe que
les agonistes du GnRH, par une modification chimique de a structure du
GnRH natif (substitution d'acides aminés en position 2 et 3, site
de l'activité biologique de la molécule native). Ces molécules
agissent pas compétition avec le GnRH endogène au niveau
des récepteurs hypophysaires, et, à la différence
des agonistes, ont un effet immédiat de blocage de la sécrétion
hypophysaire des gonadotrophines.
Elles ont une action prédominante sur la sécrétion
de LH (baisse du taux plasmatique jusqu'à 80%, avec un maximum 10h
après la prise) et empêchent donc la survenue du pic de LH
endogène.
Ces molécules avaient été synthétisées dans les années 80 mais leurs effets secondaires les rendaient impropres à l'usage clinique. La troisième génération de ces molécules, mieux tolérée, a été mise sur le marché en 2000. Il s'agit du cétrorelix (spécialité Cetrotide: 0,25mg et 3mg) et du ganirelix (spécialité Orgalutran: 0,25mg).
L'effet de ces substances sur des tissus autres que l'hypophyse est possible ( présence de récepteurs au GnRH sur l'ovaire, l'endomètre, les trompes, la zone pellucide, l'embryon...) , comme pour les agonistes, et la question de leurs conséquences reste posée.
La plus grande discussion concernant l'utilisation de ces antagonistes
a concerné le choix des doses.
Dès 1991 des études avaient commencé sur les premiers
antagonistes pour déterminer les doses minimales assurant
une prévention du pic de LH.
Les études sur les molécules de troisième génération
ont essayé de préciser les doses optimales en terme
de survenue de grossesses.
Il existe actuellement deux schémas d'utlisation au cours d'une stimulation par gonadotrophines exogènes de type FSH ou HMG:
Les taux de grossesses obtenus dans ce type de protocole sont restés
pendant plusieurs années inférieurs à ceux des protocoles
avec agonistes. Mais aujourd'hui ces taux semblent équivalents.
De plus les protocoles avec antagonistes présentent de nombreux
avantages relatifs au confort pour la patiente, aux risques liées
à la stimulation ovarienne et au coût.
Le développement du génie génétique a permis la production de ces hormones gonadotropes, grosses molécules complexes. Ce sont des glycoproteines composées de 4 sous unités protéiques (deux sous-unité alpha communes à FSH et LH et deux sous-unités bêta spécifiques, d'une centaine d'acides aminés chacune) couplées à une partie glucidique (dont la terminaison d'acides sialiques détermine par sa présence ou son absence, l'évitement ou non de l'élimination urinaire de la molécule). Leur production nécessite le recours à des cellules de mammifères (cellules ovariennes CHO de hamster chinois) pour que la glycosylation finale des chaînes peptidiques soit réalisée.
La première gonadotrophine produite par génie générique
fut la FSH (FSHr). Cette FSH recombinante existe actuellement sous le nom
de follitropine. Elle est sensiblement plus basique que la FSH urinaire,
ce qui lui donne une durée de vie plus brève mais une activité
biologique plus forte in vitro. In vivo les tests biologiques ne sont pas
assez sensibles pour évaluer la différence. Par ailleurs
les concentrations sont toujours fournies en Unités Internationales,
mais passent progressivement à un système de référence
pondéral, beaucoup plus fiable.
Toutes les études visant à comparer l'efficacité
de la FSH recombinante de la FSH urinaire ont montré que le nombre
d'ovocytes recueillis était supérieur avec la FSHr et ceci
avec des doses moindres et une durée d'administration
plus courte. En dépit d'un coût supérieur, la follitropine
est ainsi majoritairement prescrite aujourd'hui.
De manière similaire à la FSH , d'autres gonadotrophines ont été produites par génie génétique: la LHr et l'hCGr sont actuellement disponibles sur le marché. Comme la FSHr, elles sont d'une grande pureté et d'une grande constance d'un lot à l'autre. En ce qui concerne l'hCGr, elle présente une efficacité similaire à celle extraite d'urine mais est mieux tolérée sur le plan local (injection sous-cutanée).
Epilogue
Actuellement le clinicien dispose d'une large gamme de protocoles et de molécules lui permettant d'adapter au mieux le traitement de FIV au cas particluier de la patiente.