Le gène P53
Le gène P53
Le gène RB est le premier gène suppresseur de tumeur à avoir été cloné et séquencé, il est considéré comme le prototype de ce type de gène. Depuis, de nombreux gènes suppresseurs de tumeurs ont été identifiés. Le plus emblématique est le gène P53, muté et impliqué dans plus de 50% des tumeurs, et reconnu comme tel en 1989, très peu de temps après la découverte du gène RB. L’importance de ce gène P53 est telle qu’on a surnommé la protéine P53 la gardienne du génome. Cependant la protéine P53 avait été considérée pendant une dizaine d’années comme une protéine oncogénique. Les documents suivants ont été conçus pour permettre de répondre à cette interrogation.
![]() Documents « Le gène P53 un proto oncogène ou un gène suppresseur de tumeur ? »
Documents « Le gène P53 un proto oncogène ou un gène suppresseur de tumeur ? »
Exploitation :
1 – Les informations fournies par le modèle souris
Les élèves doivent d’abord bien saisir que le protocole expérimental utilisé fait que toutes les cellules de la souris ont le même génotype de sorte qu’en comparant les trois classes de souris, on va étudier l’influence de la perte de fonction d'un ou de deux allèles P53 sur la cancérisation des cellules.
On constate que dans la première expérimentation avec la lignée C57BL6, près de 100% des souris dépourvues d'allèles fonctionnels du gène P53 (P53-//P53-) sont mortes à 6 mois, alors que la mortalité des souris hétérozygotes (P53+//P53-) ne débute que vers 9 mois, et qu’une seule souris ayant deux allèles P53 fonctionnels est morte durant la durée de l’expérience.
Puisque les souris appartiennent toutes à la même lignée et qu’elles ont été élevées dans les mêmes conditions, on peut en conclure que l’absence de tout allèle fonctionnel du gène P53, si elle n’empêche pas le développement des souris, entraîne néanmoins une mort prématurée. Surtout, plus de 80% des souris de génotype P53-//P53- ont présenté des tumeurs durant leur vie, et très précocement, contre 17% des hétérozygotes (P53+//P53-) et moins de 3% des souris P53+//P53+. On constate aussi que les tumeurs sont apparues plus tardivement chez les hétérozygotes que chez les homozygotes P53-//P53-.
On peut donc en conclure que l’absence de tout allèle fonctionnel du gène P53 favorise l’apparition des tumeurs. Puisqu’une tumeur a pour origine une seule cellule, cela signifie que l’absence d’allèle P53 fonctionnel a pour effet d’augmenter la probabilité pour une cellule de devenir cancéreuse.
Le pourcentage de souris hétérozygotes P53+//P53- développant des tumeurs est plus important que celui des souris de génotype normal. L’absence d’un seul allèle fonctionnel prédispose donc les cellules à devenir cancéreuses, même si cette prédisposition est inférieure à celle constatée en l’absence de tout allèle P53 fonctionnel.
Puisque l’absence d’un allèle P53 normal, et encore plus celle de 2 allèles normaux, prédispose fortement à l’apparition de tumeurs, cela signifie que chez les animaux P53+//P53+ élevés dans les mêmes conditions, les allèles P53 normaux s’opposent à la cancérisation des cellules. Cela est une caractéristique d’un gène suppresseur de tumeur. Il faut garder à l'esprit que la cellule est soumise à des facteurs internes ou externes qui tendent à provoquer sa cancérisation, et que le rôle de P53 est de s'y opposer en permanence.
La deuxième expérimentation avec la deuxième lignée de souris débouche globalement sur les mêmes constats et donc les mêmes conclusions sur la fonction suppresseur de tumeur du gène P53. Toutefois, on constate que les hétérozygotes de cette lignée développent plus rapidement et fréquemment des tumeurs que ceux de la première expérimentation. Cela indique que la fonction de P53 dépend d'autres caractéristiques génétiques et suggère que le gène P53 n’est pas le seul en cause dans la cancérisation.
2 - Les informations fournies par l’analyse d’un arbre généalogique dans l’espèce humaine
Un cas de cancer héréditaire
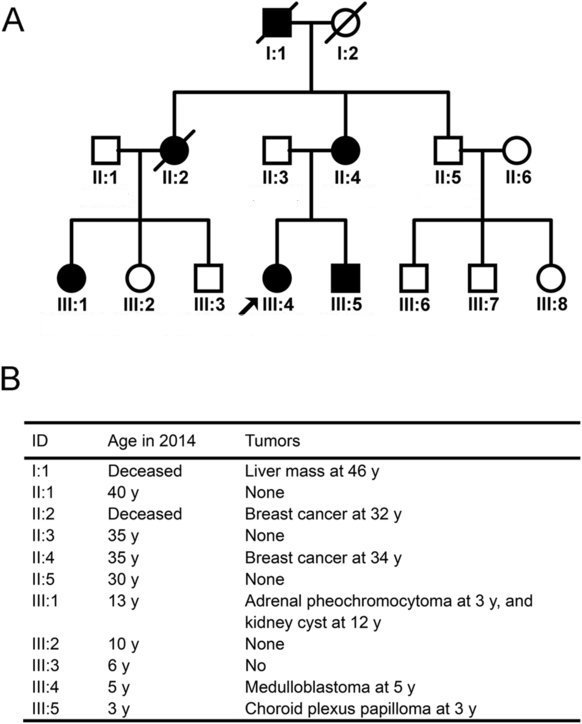
On constate des cas de cancer dans cette famille sur trois générations. En outre, ces cancers sont précoces par rapport à l’apparition des cancers dans la population générale : 3 , 5 et 12 ans pour les enfants de la troisième génération, 32 et 34 ans pour les personnes de la deuxième génération, 46 ans pour l’homme de la première génération. On constate également la diversité des cancers dans la famille : cancer du foie, cancer du sein, cancer du cerveau, du rein. Ces informations laissent à penser que le cancer est héréditaire dans la famille (au sens courant du terme).
Un cancer héréditaire où le gène P53 est en cause
La détermination des génotypes des membres de la famille réalisée par les cliniciens permet de savoir si le gène P53 peut être en cause et tester l’idée de cancer héréditaire
Le mieux est de commencer par l’analyse des génotypes des cellules cancéreuses des enfants III4 et III5 et de comparer leurs allèles P53 à la séquence de l’allèle de référence. On constate que ces cellules cancéreuses possèdent deux allèles mutés du gène P53. La mutation est en position 730 dans la séquence codante pour les deux allèles. C’est une mutation faux sens qui entraîne une substitution d’un acide aminé en position 244 de la protéine (Gly244Ser). Le génotype des cellules cancéreuses de III1 possède un seul allèle P53 et il est muté, identique à ceux des individus III4 et III5. Ces données confortent l'idée qu'une mutation de P53 est associée à la cancérisation et peut en être une des causes.
Le génotype des cellules non cancéreuses de III1, III4 et III5 est hétérozygote avec un allèle P53 normal et un allèle P53 muté identique à celui des cellules cancéreuses. Puisque toutes les cellules non cancéreuses de ces individus possèdent le même allèle muté, cela signifie qu'il est hérité d'un des parents de ces individus. Cela est confirmé par l'analyse du génotype de la femme II4. La fille III1 a probablement hérité son allèle muté de sa mère II2 (décédée, dont on ne dispose pas du génotype mais qui a été victime d'un cancer du sein). Les femmes II2 et II4 ont sans doute hérité cet allèle de leur père qui est décédé d’un cancer du foie à 46 ans mais pour lequel on ne dispose pas d’information sur son génotype.
Les données génétiques confirment donc l’idée de cancer héréditaire que laissait présager l’analyse de l’arbre.
Les cellules du garçon III3 possèdent toutes un allèle muté du gène P53 et pourtant il n’a pas développé de cancer. Cela permet de bien insister sur le fait que ce qui est hérité c’est une prédisposition au cancer.
Le gène P53 un gène suppresseur de tumeur
La comparaison des génotypes des cellules cancéreuses et non cancéreuses des enfants victimes d’un cancer montre que les cellules cancéreuses possèdent deux allèles mutés du gène P53 et les cellules non cancéreuses un seul allèle muté, celui hérité d’un de leurs parents. Cela indique que dans une cellule somatique à l’origine d’une tumeur, une mutation de l’allèle normal P53 est intervenue. Dans le cas de cette famille, la mutation est la même que celle de l’allèle hérité mais ce n’est pas toujours le cas. La corrélation entre cellule cancéreuse et possession de deux allèles mutés laisse à penser que cela est nécessaire pour que la cellule devienne cancéreuse. Cela est caractéristique des gènes suppresseurs de tumeur. Il faut souligner que souvent la deuxième mutation consiste en une délétion complète de l'allèle normal (ce qui est le cas chez la fille III1).
La notion de gène P53 en tant que gène suppresseur de tumeurs est confirmé par l'expérience de transfection. L'allèle sauvage transfecté ralenti nettement la multiplication des cellules cancéreuses contrairement à l'allèle muté. L'allèle normal s'oppose donc à la prolifération des cellules cancéreuses.
P53 un gène impliqué dans de multiples cancers
Le cancer héréditaire envisagé, désigné sous le nom de syndrome de Li-Fraumeni, est heureusement rare. Il ne faudrait pas que les élèves concluent que le gène P53 est seulement impliqué dans ce syndrome. En réalité, lorsqu’on dit que le gène P53 est impliqué dans plus de 50% des cancers, il s’agit de cancers non héréditaires. Et là aussi, très généralement, les cellules cancéreuses n’ont pas d’allèle P53 normal ; elles possèdent deux allèles mutés (la nature de la mutation varie avec le type de cancer ; par exemple dans le cancer du foie c’est généralement le codon 249 qui est muté, mutation provoquée souvent par un facteur d’environnement d’origine alimentaire, l’aflatoxine). Souvent il n’y a qu’un seul allèle muté, le deuxième allèle est délété.
Remarques : mutation germinales et mutation somatiques
Ces documents sur le gène P53 ont été envisagés dans l’optique du programme de première S sur la cancérisation. Comme le document sur la génétique du rétinoblastome, ils peuvent être utilisés en classe de seconde pour aborder la notion de mutation, en particulier la distinction entre mutations germinales et mutations somatiques, indispensable pour envisager l’origine de la diversité du vivant. Par exemple, dans l’analyse de l’arbre généalogique sur le syndrome de Li-Fraumeni les chercheurs précisent que les parents de l’homme I1 ont vécu jusqu’à 80 ans sans avoir de cancer. Ils possédaient probablement deux allèles normaux du gène P53. Cela pose le problème de l’origine de l’allèle muté présent chez I1 ce qui conduit à la notion de mutation germinale. La nécessité d’une seconde mutation pour que la cellule devienne cancéreuse introduit la notion de mutation somatique. Dans la brochure Anagène cet exemple avait déjà été utilisé pour introduire ces notions. Pour faire apparaître directement la mutation, on avait simplifié en donnant à la cellule cancéreuse un seul allèle muté du gène P53. La documentation fournie maintenant est scientifiquement plus correcte et permet sur un seul exemple d’aborder les deux types de mutations.
3 - Le gène P53 : gène suppresseur de tumeurs et oncogène
Une concentration cellulaire variable de la protéine P53
Le gène P53 situé sur le bras court du chromosome 17 code pour une protéine nucléaire de 393 acides aminés. Lorsque la cellule n’est pas soumise à un stress, la concentration cellulaire de la protéine P53 est très faible. Cela est dû à ce que la demi-vie de la protéine est très courte, de l’ordre de 5 à 10 minutes. Autrement dit, la protéine P53 est dégradée très peu de temps après avoir été synthétisée. Le rôle de la protéine P53 dans la cellule non soumise à un stress est relativement mineur.
La cellule peut être soumise à des stress variés (stress causé par des altérations de l’ADN dues à des agents génotoxiques, stress dû à l’activation d’oncogènes, stress causé par l’hypoxie, etc.) ou à une privation métabolique. C’est dans la réponse à ces stress que la protéine P53 joue un rôle fondamental. On constate dans ce cas une augmentation de la concentration de la protéine P53 qui peut être de l’ordre de 15 à 20 fois supérieure à la normale. Cette augmentation n’est pas due à une transcription plus forte du gène P53 mais à une stabilité accrue de la protéine causée par une forte diminution de sa dégradation. En outre, la protéine P53 subit des modifications post-traductionnelles qui font qu’elle est plus active. Ces modifications sont en particulier, des phosphorylations au niveau de résidus sérine et thréonine de la molécule. Autrement dit, par des voies métaboliques complexes, le stress cellulaire modifie quantitativement et qualitativement la protéine.
Mode d'action de la protéine P53
Le gène P53 code pour une protéine P53 qui est un facteur de transcription, c'est-à-dire qui se lie à des séquences bien définies dans la région régulatrice de nombreux gènes pour en activer l’expression.
![]() Document : « Mode d'action de la protéine P53 »
Document : « Mode d'action de la protéine P53 »
Exploitation
Les gènes cibles sont très nombreux. Les plus importants sont ceux qui contrôlent le déroulement du cycle cellulaire, notamment sa progression de la phase G1 à la phase S, ceux qui interviennent dans la réparation de l’Adn, ceux qui déclenchent l’apoptose, c'est-à-dire un suicide cellulaire. La protéine P53 activée suite à des altérations de l’ADN active ainsi l’expression de gènes qui directement ou indirectement bloquent le cycle cellulaire en phase G1 et activent ceux qui assurent la réparation des lésions de l’ADN. Si les altérations de l’ADN sont trop importantes pour être réparées, la protéine P53 active la voie métabolique qui conduit à l’apoptose de la cellule.
Ces informations générales sur les fonctions de la protéine P53, sont donc conformes à ce qu’on peut attendre d’un gène suppresseur de tumeur.
Les protéines P53 mutées
Dans plus de 50% des tumeurs, les cellules cancéreuses possèdent au moins un allèle muté du gène P53. Cela suggère une implication de ce gène dans la cancérisation de la cellule. Les mutations sont situées tout au long de la séquence codante mais la grande majorité d’entre elles sont situées dans la région de la séquence qui code pour le domaine de la protéine qui se lie à L’ADN.
Les protéines p53 mutantes se dégradent beaucoup moins vite que la protéine normale, ce qui fait que leur concentration dans la cellule est très nettement supérieure à celle de la protéine normale. C’est d’ailleurs à cause de cela que le gène P53 a été considéré durant les années 80 comme un proto- oncogène qui muté devenait oncogénique.
Actuellement, on sait que les protéines mutantes ont une activité transcriptionnelle très réduite par rapport à la protéine sauvage. Elles se lient mal à l’ADN des séquences régulatrices des gènes cibles. En conséquence, dans une cellule qui a subit un stress causé par des lésions de l’ADN ou dû à l’action d’oncogènes, les protéines P53 mutantes n’activent pas l’expression des gènes qui assurent l’arrêt du cycle cellulaire en phase G1, ni ceux qui assurent la réparation de l’ADN. Il y a donc une perte de fonction des protéines mutantes par rapport à la protéine normale, ce qui conforte le gène P53 comme gène suppresseur de tumeur. Cette perte de fonction peut faciliter la cancérisation de la cellule.
Certains allèles P53 mutants sont aussi des oncogènes
Cependant le gène P53 a des caractéristiques différentes de celles des autres gènes suppresseurs de tumeurs dont le prototype est le gène RB. Chez ces gènes, la perte de fonction de la protéine qu’ils codent est due à des mutations ponctuelles non-sens, des délétions ou insertions qui entraînent l’apparition d’un codon stop anticipé. En conséquence les protéines mutantes de ces gènes sont très raccourcies, rapidement dégradées. En revanche la majorité des mutations affectant le gène P53 sont ponctuelles et faux sens entraînant la substitution d’un acide aminé par un autre.
Les protéines mutantes P53 ont la même longueur que la protéine normale et on a vu qu’elles sont plus stables. Des études récentes ont conduit à la conclusion que certaines de ces protéines P53 mutantes exercent de nouvelles activités au sein de la cellule par rapport à la protéine normale. On peut parler de gain de fonction. Ainsi, l’expression du gène P53 porteur de mutations ponctuelles faux sens va au-delà de la simple perte de fonction car elle peut augmenter considérablement le potentiel oncogénique des cellules tumorales. Il semble que ce soit important dans l’évolution des tumeurs, des phénotypes des cellules tumorales.
On revient ainsi à l’idée de P53 comme oncogène exprimée durant les années 80. Plus précisément, la fonction normale du gène P53 est d’être un gène suppresseur de tumeurs assurant l’intégrité du génome de la cellule. Muté, le gène P53 perd cette fonction mais certaines des mutations faux sens du gène font qu’il se comporte comme un oncogène. On saisit l’importance de P53 dans l’évolution du processus cancéreux car muté (certaines mutations) il perd sa fonction de gardien du génome et acquiert celle d’être un oncogène.
