Le spectromètre de masse
La spectrométrie de masse est une technique physique d'analyse extrêmement sensible qui permet de détecter et d'identifier des structures moléculaires par mesure de leur masse.
À l'origine la spectrométrie de masse servait à détecter et séparer les différents isotopes d'un élément chimique. C'est Joseph John Thomson, déjà célèbre pour avoir découvert l'électron en 1895 (prix Nobel de physique en 1906), qui en a établi le principe en mettant au point un appareil lui permettant de séparer les atomes par leur masse, montrant ainsi l'existence d'isotopes stables du néon. Cette séparation des atomes réalisée en 1908 constitue le premier exemple de la spectrométrie de masse.
|
J. J. Thomson | |
Cet appareil fut ensuite perfectionné par Arthur Jeffrey Dempster et Francis William Aston qui reçu en 1922 le prix Nobel de chimie 1922 "pour sa découverte, au moyen de son spectrographe de masse, des isotopes d’un grand nombre d’éléments non radioactifs et de son énonciation de la règle des nombres entiers". Au début de la 2ème Guerre Mondiale, le spectromètre de masse prend toute sa dimension avec le Projet Manhattan. De 1938 à 1945, Alfred Nier met au point des spectromètres à double focalisation pour séparer l'235U et l'238U (spectrométrie préparative).
|
F. W. Aston |
A. Nier |
Depuis, la technique de la spectrométrie de masse n'a cessé de se perfectionner pour intervenir dans pratiquement tous les domaines scientifiques : chimie, biologie, médecine, physique, astrophysique ... et géologie. | ||
- Principe de la spectrométrie de masse
Pour réaliser une datation isotopique, nous avons besoin de mesurer les rapports d'abondance des isotopes d'un même élément chimique, c’est-à-dire des rapports de nombre d’atomes (grandeurs sans unité). Par exemple, pour réaliser une datation par la méthode Pb-Pb, il faut déterminer la composition isotopique du plomb de l'échantillon: rapports 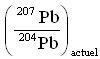 et
et 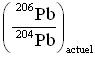 .
.
Les atomes de l'élément chimique dont on veut déterminer la composition isotopique sont ionisés dans une chambre à vide. Il existe plusieurs procédés d'ionisation (bombardement électronique, thermoïonisation TIMS, ionisation ICPMS dans un plasma d'argon, bombardement ionique ...). Les ions ainsi produits sont ensuite accélérés par un champ électrique pour former un faisceau d'ions qui va passer dans un champ magnétique. Ce champ va exercer une force qui dévie les ions du faisceau d'autant plus que l'ion est léger. Les ions sont ainsi séparés selon leur masse. Les signaux correspondant aux divers isotopes sont ainsi collectés et les rapports isotopiques mesurés.
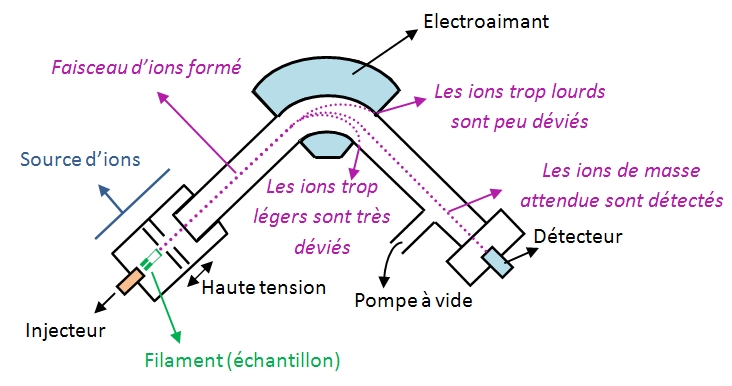
- Principe de la mesure
On commence par mesurer très précisément la masse d’échantillon de roche ou de minéraux à analyser. Des séparations chimiques très minutieuses sont ensuite réalisées. Ces préparations sont souvent longues et délicates. Elles sont le fruit de plusieurs années de recherche et font l'objet d'un développement continu. Les rapports isotopiques sont obtenus au bout d'une centaine de cycles de mesures répétitives. L'analyse des échantillons peut durer plusieurs heures. Les mesures sont ensuite traités statistiquement par ordinateur (calculs de moyennes, d'écarts-type, d'erreurs relatives commises). Les techniques actuelles permettent de mesurer des rapports isotopiques avec des précisions de 10-6 (quelques ppm) sur des échantillons de quelques nanogrammes (10-9 g) voire de quelques picogrammes (10-12 g).
La salle où sont préparés les échantillons à analyser (Laboratoire de Géochimie et Cosmochimie - Institut de Physique du Globe de Paris). |
La salle de préparation. |
Le sas d'entrée de la salle de préparation : il faut ôter ses chaussures, porter une combinaison et même ôter toute trace de maquillage pour éviter de contaminer les échantillons ! |
L'échantillon à analyser est placé sur le filament de plusieurs supports de ce type. |
Les supports sont ensuite disposés sur un barillet.
|
Le barillet est introduit dans le spectromètre de masse. |
Le dispositif d'ionisation permet de produire des ions. |
|
Merci à Gérard Mahnès et Christa Göpel, chercheurs CNRS au laboratoire de Géochimie et Cosmochimie de l'Institut de Physique du Globe de Paris pour leur accueil et la visite de leur laboratoire.