les méthodes de datation et calibrages
Datation 14C calibré
Qu'est ce que le 14C ?
Un atome, élément constitutif de la matière, est formé d'un nuage d'électrons gravitant autour d'un noyau. Le noyau d'un atome est formé de deux types de nucléons, les protons et les neutrons, de masse sensiblement égale, légèrement supérieure pour les neutrons. Chaque proton est porteur d'une charge positive, un neutron est électriquement neutre. Un électron présente une masse très faible par rapport à un nucléon, il est porteur d'une charge négative.
L'ensemble des charges négatives des électrons est compensé par l'ensemble des charges positives du noyau, le nombre d'électrons étant égal au nombre de protons.
La faculté d'établir des réactions chimiques est conférée par le nombre d'électrons donc de protons.
Un élément chimique est donc caractérisé par le nombre de protons de son noyau. Il peut posséder un nombre variable de neutrons, on parle alors d'isotope. L'élément carbone est caractérisé par la présence de 6 protons. Les noyaux de carbone peuvent posséder 6 neutrons pour le carbone 12 (6 protons + 6 neutrons), 7 neutrons pour le carbone 13 (6 protons + 7 neutrons) ou 8 neutrons pour le carbone 14 (6 protons + 8 neutrons).
Les isotopes 12C et 13C sont stables tandis que le 14C est instable, il se désintègre au cours du temps en 14N avec émission de radioactivité.
Origine naturelle du 14C
La Terre est bombardée en permanence par des particules très énergétiques en provenance du cosmos. Ce rayonnement cosmique contient des protons qui sont plus ou moins déviés par le champ magnétique terrestre. Certains de ces protons pénètrent dans l'atmosphère et provoquent l'explosion des noyaux présents dans la hautes atmosphère. Parmi les fragments se trouvent des neutrons. Ceux-ci réagissent avec l'azote de l'air en éjectant un proton et en prenant sa place. Le nouveau noyau ne compte plus que 6 protons au lieu de 7 il s'agit d'un noyau de carbone. Ce dernier renferme 8 neutrons, c'est du 14C.
On peut résumer la réaction de la façon suivante :
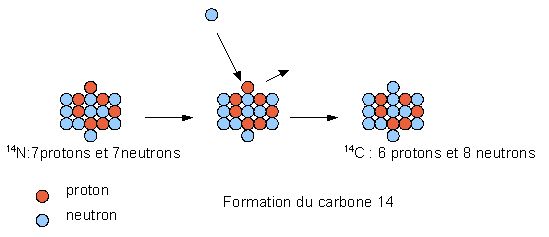


Devenir du 14C
Le 14C est un isotope instable du carbone, il se désintègre avec émission d'un rayonnement β-, un proton va alors acquérir une charge et devenir un proton. On obtient à nouveau du 14N:
la désintégration du 14C se réalise selon une fonction exponentielle du temps; le temps de demie vie est de 5570 ans, c'est à dire qu'il faut ce laps de temps pour la moitié du 14C initial se désintègre en 14N.
Utilisation du 14C comme radiochronomètre
Dans l'atmosphère Le 14C réagit rapidement avec l'oxygène atmosphérique, il se forme alors du 14CO2. Le14C est incorporé dans la chaîne alimentaire par photosynthèse au même titre que les 12C , le rapport 14C/12C dans la matière vivante est égal à celui de l'atmosphère. A la mort d'un organisme vivant il n'y a plus d'apport de nouveau 14C, le système se ferme, la quantité de 14C commence à baisser par désintégration et le rapport 14C/12C diminue de même que la radioactivité de l'échantillon.
Si l'on suppose que le rapport 14C/12C atmosphérique est resté constant au cours des derniers 50 000 ans, la mesure de ce rapport 14C/12C ou de la radioactivité d'un échantillon de matière organique permet de mesurer son âge.
La datation au14C ne peut être réalisée que sur de la matière contenant du carbone, comme du bois fossilisé, de la tourbe, du pollen, des os etc. L'échantillon doit être daté de moins de 50 000 ans, au delà la quantité de 14C encore présente dans l'échantillon est devenue trop faible pour effectuer une datation fiable.
Ernie Anderson et Willard Libby, en sont les inventeurs en 1947
Calibration des dates 14C : pourquoi et comment
La comparaison de la datation 14C sur de très vieux arbres, à croissance lente avec la dendrochronologie ( datation basée sur les cernes de croissance annuelle des arbres) ont montré un désaccord entre les deux méthodes de datation.
La datation au 14C suppose que le rapport isotopique 14C/12C ait été constant dans l'atmosphère au cours du temps. En fait la formation de 14C varie avec les fluctuations de l'activité solaire et les variations du champs magnétique terrestre. Un objet s'étant formé à une période à fort taux de 14C apparaît, par datation absolue, plus jeune qu'en réalité car enrichie en 14C.
De même l'activité humaine perturbe ce rapport 14C/12C. Depuis le début de l'ère industrielle, la combustion de matière carbonée fossile ayant perdu depuis longtemps son 14C, a libéré dans l'atmosphère de grandes quantités de CO2 pauvre en 14C.
Plus récemment des explosions nucléaires à l'air libre ont produit de grandes quantités de 14C.
On a alors déterminé pour chaque époque le rapport 14C/12C disponible. On obtient ainsi une courbe de calibration à partir de laquelle on peut établir pour une datation 14C , un age 14C calibré assorti d'une marge d'erreur. Il existe plusieurs courbes de référence, pour chaque age 14C cal on précise la courbe utilisée.
La calibration des dates radiocarbone conventionnelles exprimées en date BP ( Before Present ) se fait grâce à des programmes informatiques. Le résultat est un intervalle de temps en années réelles (Calendrier AV. et/ou AP. J.C.) avec également un calcul de distribution de probabilités.
Usuellement, on retient l'intervalle de temps ayant une probabilité de 95%.
Exemple:
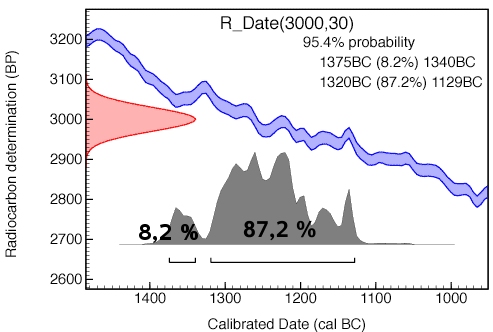
Ce graphique montre comment la mesure du radiocarbone 3000 +- 30BP serait calibré. L'ordonnée affiche l'âge radiocarbone exprimé en années BP et l'abscisse les années réelles, ici BC. Les courbes bleues représentent les mesures de radiocarbone à partir des cernes d'arbres (avec marge d'erreur) et la courbe rouge indique la concentration radiocarbone dans l'échantillon. L'histogramme gris montre l'âge réel probable de l'échantillon.
Les résultats sont souvent donnés comme une tranche d'âge (probabilité à 95%). Dans le cas présenté, nous pourrions dire que l' âge de l'échantillon est compris entre 1375 et 1129 ans
http://forums.futura-sciences.com/archeologie/124963-techniques-archeo-datations-14c-bp-bc-cal.html
Des sites internet permettent un calcul en ligne:
