propriétés physico-chimiques de l'eau
Structure et propriétés
- L'atome d'oxygène possède 6 électrons périphériques. Sa valence (nb. de liaisons) est égale à 2. L'hydrogène possède un électron périphérique et établit une liaison de covalence. Voici la structure de la molécule d'eau.
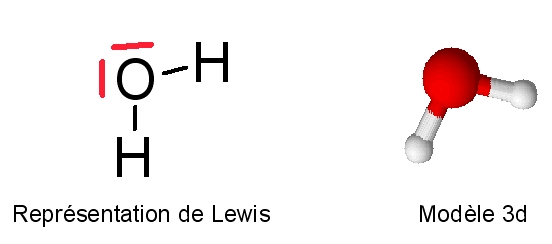
Du fait de la présence de deux doublets non liants sur l'atome d'oxygène, l'eau a une structure tétraédrique (type AX2E2 en méthode VSEPR). La géométrie de la molécule d'eau est donc coudée. Les études spectroscopiques montrent que l'angle H-Ô-H est de 104,5° et que la distance interatomique dO-H = 95,7 pm (picomètre) soit 9,57.10-11 m.
Ces considérations géométriques expliquent en partie la polarité de la molécule d'eau et ses propriétés de solvant.
L’oxygène étant beaucoup plus électronégatif que l’hydrogène, le doublet d'électrons de chaque liaison O-H se déplace donc vers l'atome d'oxygène. Cela se traduit par un excédent de charges négatives sur l’atome d'oxygène (d’où l’apparition de 2 charges négatives partielles notées d-) et un déficit sur l’atome d’hydrogène (d’où l’apparition de 2 charges positives partielle notées d+, la molécule étant électriquement neutre). On dit que les deux liaisons O-H sont polarisées. Du fait de sa géométrie coudée, le barycentre des charges partielles positives ne coïncide pas avec celui des charges partielles négatives (en vert sur le schéma).
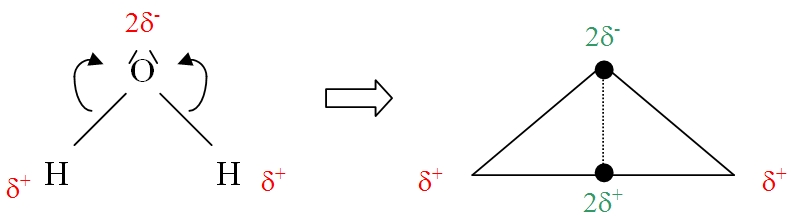
La molécule d'eau est donc polaire (on dit aussi dipolaire). Elle constitue un dipôle électrique permanent (un dipôle électrique étant l’ensemble de deux charges égales et de signes contraires à une distance fixe l’une de l’autre). Cela explique qu'elle soit un bon solvant pour les électrolytes solides, liquides ou gazeux (ex : pour les molécules polaires comme HCl ou pour les solides ioniques cristallins comme le sel). En effet, l'eau peut dissoudre tous les solides ioniques cristallins, conduisant à des solutions comportant des ions solvatés. C'est pourquoi l'eau intervient dans de nombreux phénomènes géologiques (voir ici).
- L'eau est un composé thermiquement stable. A partir de 3000°C, elle peut se dissocier selon l'équation : H2O(g) -> H2(g) + 1/2 O2(g). C'est une transformation endothermique.
Cette dissociation peut également se produire sous l'effet d'un rayonnement électromagnétique. Pour qu'une liaison O-H soit rompue, il faut fournir une énergie au moins égale à l'énergie de liaison DO-H soit 461,6 kJ.mol-1. Calculons l'énergie nécessaire à un photon pour casser la liaison O-H :
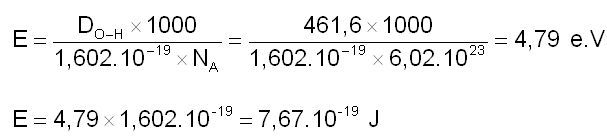
On peut maintenant en déduire la longueur d'onde de ce photon en appliquant la relation de Planck :
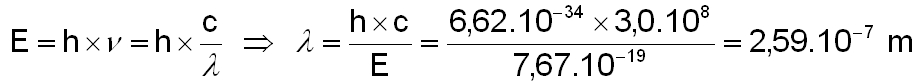
Cela correspond à un rayonnement de longueur d'onde inférieur à 259 nm (rayonnement U.V). La vapeur d'eau peut donc être dissociée par le rayonnement U.V solaire dans les couches supérieures de l'atmosphère terrestre. On verra que cette propriété peut expliquer l'absence d'eau sur certaine palnètes du système solaire. Sur Terre, la durée de vie de la molécule d’eau est de 36 heures (cette durée de vie étant définie comme le temps nécessaire pour que le nombre de molécules soit diminué d’un facteur 2 par photodissociation due au rayonnement UV solaire).
- La transformation inverse correspond à la synthèse de l'eau : H2(g) + 1/2 O2(g) -> H2O(g). Il s'agit d'un mécanisme complexe qui se déroule en plusieurs phases, (initiation, propagation et rupture) avec formation de radicaux. Cet ensemble de réactions chimiques conduisant à la molécule d’eau à partir des atomes O et H est très exothermique. C'est ce qui rend possible la formation de l'eau dans le milieu interstellaire, à basse température, sans nécessiter la présence d’une source d’énergie externe.
Cela témoigne d'un milieu où les molécules sont très associées. En effet, il existe dans l'eau liquide et dans la glace des liaisons intermoléculaires de type électrostatique : les liaisons hydrogène (liaison H). Il s'agit de liaisons impliquant l'atome d'hydrogène d'une molécule et le doublet non liant de l'atome d'oxygène d'une autre molécule. Ces liaisons sont assez difficiles à briser. Elles confèrent donc une grande stabilité physique à ces deux phases de l'eau. A quantités de matière égales, la glace occupe un plus grand volume que l'eau liquide. Cela est dû aux liaisons H. En établissant ses liaisons, les molécules d'eau adoptent une disposition spatiale qui conduit à une structure peu compacte pour la glace et a un comportement très particulier : la glace étant moins dense que l'eau liquide, la glace flotte sur l'eau. Peu de substances possède cette caractéristique : l'eau, le bismuth et l'antimoine. |
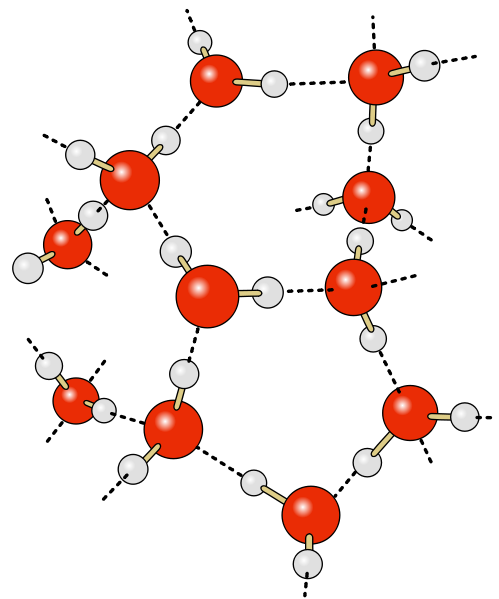 |
Le diagramme de phase de l'eau P = f(T)
Il illustre les domaines de température et de pression où l'eau se trouve à l'état gazeux, liquide et solide. Le diagramme des phases de l'eau montre que le point triple correspond à une température de 0,01°C et une pression de 6,15 hectopascals soit 6,15.10-3 bar (1 bar = 105 pascals). En dessous du point triple, l'eau ne peut pas exister sous forme liquide. La courbe de changement de phase liquide-vapeur (appelée courbe de vaporisation) est limitée supérieurement en un point appelé point critique. Au delà de ce point, l'eau devient un fluide supercritique qui possède la propriété de dissoudre des substances insolubles dans l'eau en dessous du point critique.
La pente de la courbe de fusion (changement de phase liquide-solide) est négative dans un large domaine de pression pour une température proche de celle du point triple. Cela explique qu'une augmentation de la pression favorise la fusion de la glace.
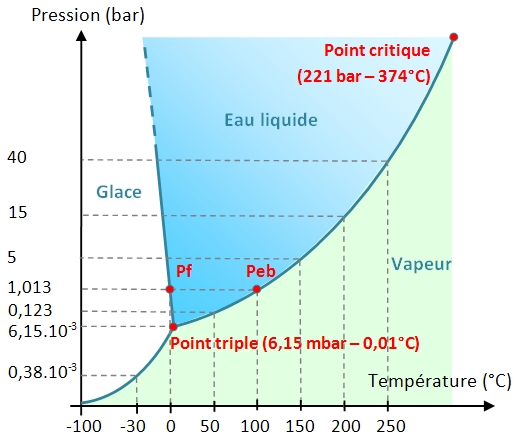
La lecture de ce diagramme permet de comprendre les raisons pour lesquelles on retrouve essentiellement de l'eau sous forme de glace et de vapeur dans le cosmos. A basse pression, et à basse température, l’eau interstellaire est présente sous forme de vapeur ou de glace amorphe. En effet, selon la température et la pression, la glace d’eau peut présenter différents types de structure cristalline. Sur Terre, elle se présente sous la forme d'un réseau hexagonal. Entre -70 °C et et -140 °C, elle est sous forme de réseau cubique. Aux températures inférieures à -140 °C , elle est amorphe (forme la plus répandue dans le milieu interstellaire).
A la lecture du diagramme, on peut espérer trouver de l'eau liquide si les conditions suivantes sont réunies :
- température comprise entre 0 et 130 °C pour des pressions comprises entre 6,15.10-3 et 2 bars : c’est le domaine des planètes telluriques et des éventuelles exoterres.
- à haute température et haute pression : c’est le domaine de l'intérieur des satellites des planètes géantes.
Les état ortho et para de l'eau (source : Thérèze Encrenaz"A la recherche de l'eau dans l'Univers", Belin suo 2004
Ces termes font référence à deux états particulier du dihydrogène H2. Ces états sont définis par la valeur du spin +1/2 ou-1/2 des protons des atomes d'hydrogène de cette molécule, le spin déterminant le "sens de rotation" du proton sur lui même. Si les deux spins nucléaires sont opposés, la molécules H2 est dite para ; si non, elle est dite ortho. Ces définitions s'appliquent également à la molécule d'eau.
Cette distinction présente un grand intérêt. En effet, on peut montrer quil y a trois fois plus de manière de parvenir à un état ortho qu'à un état para. Cela implique que les intensités des raies spectrales qui correspondent aux transitions de rotation et de vibration-rotation des deux variétés d'H2O (voir ici), intervenant à des longueurs d'onde légèrement différentes, sont dans des proportions de 3 pour 1.
D'où a possibilité de mesurer par spectroscopie le rapport des quantités des deux variétés d'H2O. Or ce rapport d'abondance dépend de la température à laquelle la molécule d'eau s'est formée (ce rapport ne pouvant être modifié par la suite). La mesure du rapport ortho/par de l'eau donne donc une indication directe sur la température de formation de la molécule.
L'eau lourde
Le noyau d'un atome est constitué de nucléons (les protons chargés positivement et les neutrons qui sont électriquement neutres). Sa représentation symbolique est 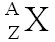 où :
où :
Z est le nombre de charges ou « numéro atomique ». C'est le nombre de protons présents dans le noyau.
A est le nombre de nucléons appelé aussi « nombre de masse ».
N = A - Z est donc le nombre de neutrons du noyau.
Un élément chimique est l'ensemble des entités (atomes ou ions) ayant le même nombre de charge Z. Alors qu'il n'y a qu'une centaine d'éléments chimiques, il y a plus de 1 500 noyaux répertoriés dont 325 naturels. En effet, pour un Z donné, il existe plusieurs noyaux qui différent par leur nombre de neutrons. Ces noyaux sont appelés isotopes.
L'hydrogène possède des isotopes stables : 1H (99,985 %) et 2H appelé deutérieum D (0,015 %). L'oxygène possède des isotopes stables : 16O (99,762 %), 17O (0,038) et 18O (0,2 %). La combinaison de ces isotopes permet d'obtenir cinq isotopes principaux pour la molécules d'eau : H216O (le plus abondant), H217O, H218O, HDO (appelée "eau semi lourde") et D2O (appelé "eau lourde"). L'eau semi-lourde est naturellement plus abondante que l'eau lourde.
HDO et D2O ont des densités plus élevées que l'eau H216O, d'où leurs noms. L’eau lourde est utilisée dans les réacteurs nucléaires comme modérateur de neutrons ; les neutrons ralentis ont alors une probabilité plus élevée d'aller provoquer de nouvelles fissions de noyaux d'uranium, permettant ainsi la réaction en chaîne. L'eau lourde est également utilisée comme détecteur de neutrinos (effet Tcherenkov).

