Le système immunitaire et le système nerveux, pas si indépendants… - Article
- Sommaire
- Introduction
- Des liens entre le comportement et l’immunité
- De l’exemple du réflexe inflammatoire à la cartographie complète des circuits neuro-immuns
- Aspects moléculaires de la communication neuro-immune : vers la perspective d’une synapse neuro-immune
- Conclusion et perspectives
- Liens vers le glossaire et la bibliographie
Introduction
Pendant longtemps, le système nerveux et le système immunitaire ont été étudiés séparément. Dans les années 1990, des études précurseurs ont toutefois montré qu’il existait une communication bidirectionnelle entre ces deux systèmes. Par exemple, des cytokines pro-inflammatoires telles que l’IL-2 ou l’IL-6 modulent le comportement chez la souris, en modifiant le taux de libération de neurotransmetteurs ou leur renouvellement dans l’hippocampe et l’hypothalamus [1]. Un tel mécanisme pourrait être un moyen pour le cerveau d’être « conscient » ou informé de l’état immunitaire du reste du corps. Réciproquement, le système nerveux peut communiquer avec les organes en périphérie, notamment en cas de stress [2–4], par la production de neurotransmetteurs, dont des exemples seront détaillés plus loin. Ainsi, les cellules immunitaires et les cellules neuronales sont capables intimement liées, et sont également capables de dialoguer entre elles, en exploitant les signaux moléculaires portés par les cytokines et les neurotransmetteurs.
Cet article vise ainsi à illustrer la connexion entre les disciplines que sont les neurosciences et l'immunologie. En effet, le fonctionnement du système immunitaire et du sytème nerveux sont enseignés respectivement en classe de Première et de Terminale générales (spécialité SVT), et la question de leur interaction est abordée dans le contexte de la réponse aux agents stresseurs : le stress. Cet article se propose donc de mettre en lumière les liens entre le système nerveux et le système immunitaire, à différentes échelles. Nous présentons la communication neuro-immune en illustrant d'abord les observations liant comportement et immunité, pour aller ensuite vers les détails moléculaires du dialogue neuro-immun. Nous discutons également des limitations du domaine de la neuro-immunologie, et développons quelques pistes explorées aujourd'hui dans les laboratoires pour résoudre les questionnements actuels.
Des liens entre le comportement et l’immunité
Une première échelle à laquelle nous proposons d’aborder la communication neuro-immune est celle des observations comportementales, qui sont en l’occurrence les plus anciennes et à la base de la discipline de la neuro-immunologie. De nombreuses études ont mis en lumière des connexions entre le comportement et l’immunité, et sont regroupées au sein d’un domaine appelé psychoneuroimmunologie. Un mécanisme soutenant ce lien entre comportement et système immunitaire a été mis au jour il y a de cela plusieurs décennies. Ader et al. avaient en effet mis en évidence qu’il était possible de conditionner le système immunitaire, comme pour un conditionnement pavlovien. Le conditionnement correspond à l’association, au niveau cérébral, d’un stimulus avec une réaction, comme par exemple l’association entre la mise en action d’un levier et l'obtention d’une récompense. Cette équipe avait injecté à des souris un antigène induisant la production d’anticorps, tout en leur administrant un stimulus gustatif. Après conditionnement, les souris produisaient des anticorps en réponse au seul stimulus gustatif, même lorsque le stimulus antigénique n’était plus présent : la réaction immunitaire avait donc été conditionnée [5] !
Des liens entre comportement et immunité en cas d'exposition aux agents stresseurs
Parmi les réactions comportementales humaines que nous expérimentons toutes et tous au quotidien, nous pouvons nous pencher sur la réponse de stress aigü. Le cortisol, et plus largement les glucocorticoïdes, ont été largement décrits comme étant libérés en condition de stress, activant ainsi la néoglucogenèse, qui a pour effet d’augmenter la glycémie. La libération du cortisol s’effectue en plusieurs étapes. Sous l’action d’un agent stresseur, l’hypothalamus libère entre autres de la Corticotropin-Realeasing Hormone (CRH), qui active la glande pituitaire (également appelée adénohypophyse ou antéhypophyse), qui en retour libère l’Adrenocorticotrophic Hormone (ACTH), elle-même activant la glande adrénale (ou corticosurrénale) aboutissant à la libération de glucocorticoïdes [3]. Le cortisol contrôle lui-même cette cascade de signalisation, en exerçant un rétrocontrôle négatif au niveau hypothalamique et hypophysaire [3]. De façon intéressante, le cortisol présente un effet inhibiteur sur le système immunitaire [6]. Le stress, en augmentant la production de cortisol, agirait donc sur le système immunitaire en inhibant l'activité des cellules immunes.
Une démonstration des inter-relations existant entre stress et système immunitaire a été obtenue par des chercheurs s’intéressant à l’empreinte que pouvait laisser un stress chronique sur le système immunitaire [4]. Les chercheurs ont transféré des lymphocytes de souris anxieuses (soumises à une période de défaite sociale, c’est-à-dire, co-hébergées avec des souris dominantes et agressives) à des souris normales. Après transfert, les souris normales ont montré, de manière étonnante, des comportements anxieux, indiquant que l’exposition à l'anxiété peut modifier la fonction des cellules immunes, qui en retour ont la capacité de modifier le comportement de l’individu. Chez l'Homme, une diminution du nombre de lymphocytes dans le sang de patients atteints de dépression a été observée, probablement liée à un taux plus élevé d’apoptose (la mort cellulaire programmée) de ces lymphocytes chez ces patients dépressifs. Cependant, au-delà de la corrélation, une réelle relation de causalité reste à démontrer chez l'Homme [8]. Les retombées de ces intéressantes observations restent encore assez peu appliquées dans le contexte médical, dans le domaine des maladies psychiatriques par exemple, par manque de données.
Des liens entre comportement et immunité en contexte pathologique : maladies inflammatoires et maladies neurodégénératives
L’inflammation est un mécanisme de défense principalement induit lorsque le corps est agressé suite à une infection ou un dommage. L'inflammation chronique peut devenir pathologique, comme c'est le cas dans les maladies inflammatoires. Des chercheurs travaillant sur le syndrome de l’intestin irritable (IBD, irritable bowel disease), une maladie inflammatoire chronique de l'intestin, ont observé une augmentation de la croissance des fibres nerveuses dans l'intestin des patients, par l’action de médiateurs immuns provenant de la muqueuse intestinale [9]. Ceci suggère donc que dans un contexte immunopathologique, le système immunitaire est capable de moduler l’innervation des organes.
Des liens neuro-immuns ont aussi été établis dans des contextes de maladies du système nerveux central, comme des maladies psychiatriques ou neurodégénératives. Par exemple, la communication neuroimmunoendocrine, c’est-à-dire la communication tripartite entre neurones, cellules immunes et organes endocrines, est perturbée dans un modèle murin de la maladie d’Alzheimer, avec des taux de cytokines périphériques élevés (IL-1, TNF) et une modification de l’innervation endocrine [10]. Ces perturbations pourraient contribuer à la progression accélérée de la maladie dans ce modèle, et ces résultats mettent donc en lumière la composante inflammatoire périphérique de la maladie d’Alzheimer. De manière similaire, chez des patients schizophrènes, l’activation de circuits neuronaux périphériques connectés à l’hypothalamus par des molécules de l'identité microbienne. En effet, des cytokines produites par des cellules immunes ou par des Pathogen Associated Molecular Patterns (PAMP), tels que le LPS produit par des bactéries Gram négatives, peuvent être responsable de l’augmentation des symptômes [11].
Ainsi, des perturbations de la communication neuro-immune peuvent contribuer à la progression de maladies périphériques mais également de maladies cérébrales. Connaître les circuits neuro-immuns impliqués permettrait de mieux comprendre les mécanismes impliqués.
De l’exemple du réflexe inflammatoire à la cartographie complète des circuits neuro-immuns
Le réflexe inflammatoire, un circuit neuro-immun bien défini
Afin de caractériser le support physique de ces interactions immuno-comportementales, la recherche s’est dirigée vers une caractérisation anatomique de la communication neuro-immune. Un circuit neuro-immun en particulier a été caractérisé en détail récemment par Tracey et collaborateurs : il s'agit du réflexe inflammatoire (ou inflammatory reflex), qui repose sur le nerf vague (Fig.1) [12].

Figure 1. Le réflexe inflammatoire, un circuit neuro-immun bien décrit.
L'activation du nerf vague par des signaux immunitaires induit une réduction de la réponse immune dans la rate [13]. La branche afférente est stimulée par la présence dans un organe périphérique de DAMP (Damage-Associated Molecular Patterns) ou d’alarmines. L’information est ensuite relayée jusqu’au cerveau, où est connectée la branche efférente. La branche efférente, support d’un signal de retour vers la périphérie, effectue un relais dans le ganglion cœliaque avec des neurones adrénergiques, qui innervent la rate et y libèrent de la noradrénaline [14]. La noradrénaline active ensuite la synthèse d’acétylcholine par un sous-type de lymphocytes T mémoire de la rate, menant à la diminution de libération de cytokines pro-inflammatoires par les macrophages de la rate [13]. Ainsi, le nerf vague est le siège d’un réflexe inflammatoire, c’est-à-dire que l’activation des afférences vagales par un processus inflammatoire périphérique va stimuler en retour les efférences vagales, entraînant un effet anti-inflammatoire anti-TNF via un réflexe vago-vagal afférent-efférent.
De plus, des lymphoyctes T mémoires similaires à ceux évoqués précédemment sont aussi présents dans les plaques de Peyer, qui sont des organes lymphoïdes secondaires localisés dans l’intestin, et dans les ganglions lymphatiques. Comme ces structures sont aussi innervées par des neurones adrénergiques, cela suggère que ces lymphocytes T pourraient également jouer un rôle similaire dans ces organes (intestin, ganglions lymphatiques). Ainsi, la stimulation du nerf vague diminue les réponses inflammatoires délétères et pourrait donc être utilisé dans le traitement de maladies inflammatoires chroniques, comme la maladie de Crohn ou l’arthrite rhumatoïde [15] : identifier précisément les circuits neuro-immuns peut donc avoir des retombées médicales directes.
Vers une meilleure cartographie des circuits neuro-immuns en utilisant… des virus !
Les neurones sont présents dans la grande majorité des tissus, et à part pour les grands réseaux de nerfs, leur cartographie dans les organes périphériques est assez mal connue. Une stratégie pour mieux cartographier les circuits neuro-immuns consiste à utiliser le traçage neuronal (ou neuronal tracing). Le traçage peut être réalisé en utilisant des colorants constitués de polymères marqués. Toutefois, cela nécessite des traitements histochimiques suite à l’injection du colorant à l’animal. De plus, les colorants peuvent se révéler peu spécifiques, menant ainsi à des erreurs d'interprétations lors de l'analyse des données [16].
Une autre approche consiste à exploiter des virus dits « neurotropes ». Leur utilisation pour le traçage requiert des modifications du génome viral [16], en insérant par exemple un gène rapporteur qui produit une protéine fluorescente, ce qui permet le suivi de l’infection. Le traçage peut avoir lieu de manière antérograde (vers la périphérie) ou rétrograde (vers le cerveau), en fonction de la présence de récepteurs viraux sur le corps cellulaire (soma) ou les axones des neurones.
Utiliser des virus pour tracer les neurones permet d’obtenir des données de meilleure qualité par rapport aux colorants, du fait de la spécificité des virus, et du fait de l’augmentation du signal grâce à la réplication virale [17]. De telles approches ont récemment permis de cartographier des connexions intestin-cerveau, en lien avec le système de la récompense [18], le contrôle de la motilité intestinale ou la détection de nutriments [19]. Ainsi, il est possible de retracer des connexions longue distance entre le cerveau et la périphérie. Ce type d’approche, qui a été utilisé pour décrire le réflexe inflammatoire (voir plus haut), devrait se révéler très utile dans les années à venir pour compléter la cartographie des circuits neuro-immuns.
Aspects moléculaires de la communication neuro-immune : vers la perspective d’une synapse neuro-immune
Les cellules immunes détectent des signaux neuronaux
Au niveau moléculaire, la communication nerveuse est assurée par les neurotransmetteurs et les neuropeptides. Comme les neurotransmetteurs, les neuropeptides peuvent induire des potentiels d’action dans les neurones post-synaptiques. Cependant, ils diffèrent de la définition des neurotransmetteurs : ce sont des molécules de nature protéique, qui ont une action plus large et plus lente, et qui sont présentes en plus faible concentration au niveau post-synaptique [20]. Il existe différents types de neuropeptides, tels que la substance P, la Calcitonin Gene-Related Peptide (CGRP) ou le Vasoactive Intestinal Peptide (VIP).
Les neurotransmetteurs et les neuropeptides peuvent influencer plusieurs volets de la réponse immune, dont la réponse innée. Ils agissent en particulier sur les Innate Lymphoid Cells (ILC), des lymphocytes de types innés récemment découverts, qui ont principalement un rôle de maintien de l’homéostasie tissulaire. Le comportement des ILC peut être finement régulé par les neurones sympathiques, qui libèrent soit de la neuromédine U (NMU) [21], qui augmente la production de cytokines par les ILC, soit de la norépinephrine (ou noradrénaline), qui au contraire diminue cette production [22] (Fig. 2).
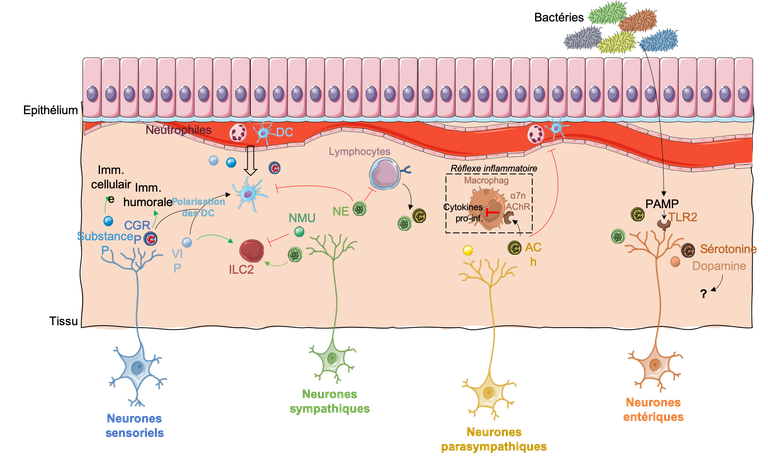
Figure 2. Le dialogue moléculaire entre neurones et cellules immunes.
Suite à l’activation de l’immunité innée, deux types de réponses adaptatives peuvent être mis en place, entre autres : l’immunité à médiation cellulaire (contrôlée par les lymphocytes T auxiliaires Th1 dits T helper 1, T auxiliaires de type 1) et l’immunité à médiation humorale (contrôlée par les lymphocytes Th2). Selon les neuropeptides libérés, la médiation de l'immunité humorale comme cellulaire peut être modulée (Fig. 2). Ainsi, la substance P booste la réponse Th1, en augmentant l’expression d’IL-1, de TNF et d’IL-6 par les monocytes [23]. Au contraire, la CGRP permet le maintien de la réponse à médiation humorale, en polarisant la présentation de l’antigène par les cellules dendritiques aux lymphocytes Th2, plutôt qu’aux Th1 [24].
D’autre part, l'activité pro-inflammatoire des DC peut être atténuée par le neuropeptide VIP, qui les polarise vers des propriétés anti-inflammatoires, menant finalement à l’induction de populations de lymphocytes B et T régulateurs [25] (Fig. 2). De plus, le neuropeptide VIP peut également contrôler les lymphocytes de manière directe, en modulant la commutation de classe d’immunoglobulines dans les lymphocytes B [26], ou en modulant la stimulation des lymphocytes T CD4+ [27]. Outre leur capacité à détecter les signaux neuronaux, les cellules B peuvent également en produire elles-mêmes. Ainsi, il a été montré qu’en présence de Nerve Growth Factor (NGF), les lymphocytes B produisent le neuropeptide CGRP, ce qui est cohérent avec le rôle précédemment décrit de la CGRP qui maintient l’immunité humorale [28] (Fig. 2).
Les cellules immunes sont principalement circulantes, sauf pour les populations résidentes des tissus comme les cellules dendritiques, les macrophages (y compris du système nerveux central - microglie), et certaines populations de lymphocytes (par exemple lymphocytes T mémoire résidents TRM). Pour être recrutés dans les tissus en cas d’inflammation, les cellules immunes ont besoin que les cellules endothéliales augmentent l’expression à leur surface de marqueurs tels que la sélectine. L’expression de la sélectine sur l'endothélium est modulée par des signaux neuronaux comme des neuropeptides, exprimés par des neurones périphériques, menant finalement au recrutement de cellules immunes telles que les neutrophiles dans les tissus [29] (Fig. 2). En plus d’influencer le remodelage endothélial, d’autres signaux neuronaux libérés par des neurones sympathiques peuvent induire une chimio-attraction des monocytes [30], ou encore des cellules dendritiques (les cellules présentatrices d’antigènes professionnelles) [31]. Ensuite, même une fois dans le tissu, la migration des cellules immunitaires peut être modulée par des signaux neuronaux, comme pour les cellules de Langerhans, qui sont sensibles aux ligands des récepteurs β2 adrénergiques, les catécholamines [32]. Ceci illustre ainsi que toutes les étapes de la mise en place de la réponse immune peut être modulée par des signaux nerveux.
Les neurones détectent des signaux immunitaires
Les neurones peuvent aussi détecter des signaux immuns, mais les connaissances en ce sens sont bien plus éparses. Les neurones peuvent en effet exprimer à leur surface des récepteurs classiquement associés au système immunitaire. Par exemple, les neurones entériques peuvent détecter les DAMP par l’expression du Toll-Like Receptor 2 (TLR2), qui est un récepteur PRR (Pattern Recognition Receptor), classiquement exprimé à la surface de cellules immunitaires innées [33].
Les neurones sensoriels peuvent aussi détecter des signaux immuns. Par exemple, la douleur peut être entretenue suite à l’activation de neurones sensoriels par CCL3, une chimiokine habituellement impliquée dans la médiation de l’inflammation et la prolifération des cellules souches hématopoïétiques, grâce à l’expression par ces neurones du récepteur CCR1 [35]. Ces neurones sensoriels peuvent ainsi agir comme des « senseurs périphériques » du statut immunitaire. En effet, il a été montré que les nocicepteurs peuvent signaler au cerveau la présence d’une infection périphérique ou de l’inflammation [36]. Une autre caractéristique intéressante des nocicepteurs est qu’ils peuvent exprimer PD-1 ou PD-L1, un couple de molécules inhibitrices désormais bien connu des immunologistes, particulièrement ceux qui étudient l'échappement des cellules cancéreuses au système immunitaire (un thème abordé dans le programme de lycée) [37]. Les chercheurs ont ainsi montré que PD-1 et PD-L1, exprimés par certains neurones nocicepteurs, pouvaient aussi jouer le rôle de neuromodulateurs et d’inhibiteurs de la douleur, en interagissant avec des cellules immunes.
À la recherche de la synapse neuro-immune
Dans l’intestin, des clusters regroupant lymphocytes B, cellules myéloïdes, ILC3 et des cellules gliales (des cellules aux nombreuses fonctions, dont celle de support pour les neurones) ont été observés [39]. L’observation de telles associations spatiales a mené à l’émergence d’un nouveau concept : les unités cellulaires neuro-immunes (Neuro-immune Cell Units, NICU) [38]. Les NICU sont des structures discrètes dans les organes, dans lesquelles les neurones et les cellules immunes sont associées de façon spatiale et fonctionnelle, c’est-à-dire qu’elles interagissent ensemble et influencent leurs comportements de manière réciproque.
Cependant, on ne sait pas encore si l’interaction neuro-immune au sein des NICU a lieu de manière synaptique ou non. Certains chercheurs emploient le mot de synapse pour décrire l’interaction entre une terminaison nerveuse et une cellule immunitaire. Par exemple, Rosas-Ballina et al. utilisent ce terme pour décrire la colocalisation entre une protéine synaptique d’un neurone (la synaptophysine), et des lymphocytes T [13]. Par ailleurs, on a observé que les contacts anatomiques entre des lymphocytes producteurs d’IgA et des neurones peptidergiques sont augmentés après stimulation au LPS, ce qui suggère la mise en place d'une synapse en réponse à la stimulation. La démonstration formelle de la mise en jeu de synapses neuro-immunes pourrait changer le paradigme de cette communication. En effet, la libération de neurotransmetteurs de manière synaptique aurait des effets bien plus spécifiques sur la cellule réceptrice qu’une libération non-synaptique. Une libération non-synaptique serait plus analogue à la neuromodulation, un processus décrit dans le cerveau et qui induit des effets moins spécifiques mais sur des populations plus larges de neurones. Les deux modalités de communication neuro-immune, synaptique et non-synaptique, pourraient en fait co-exister (Fig. 3).

Figure 3. Les perspectives de la discipline de la neuro-immunologie : cartographie des interactions neuro-immunes dans les organes périphériques, modalités synaptiques ou non-synaptiques de la communication neuro-immune et développement de thérapies neuro-immunes.
Conclusion et perspectives
Ainsi, les supports moléculaires de la communication neuro-immune ont été bien décrits ces dernières années, mais la nature précise des cellules impliquées, leur localisation et leur rôle dans la physiologie des organes restent peu décrits ou compris. Les efforts de recherche dans ce domaine ont récemment permis la caractérisation du réflexe inflammatoire, mettant ainsi en évidence un fort dialogue entre cellules immunes et neurones. De plus, les autres explorations dans le domaine ont permis de mettre en évidence que les neurones et les cellules immunes n'ont pas l'exclusivité de la production de neurotransmetteurs ou de cytokines, respectivement. Toutefois, il est aujourd’hui nécessaire de mieux caractériser d’autres circuits similaires, ce qui pourrait aboutir à l’élaboration d’un atlas de l’innervation périphérique, ainsi que la cartographie des interconnexions de ces circuits avec la physiologie immunitaire (Fig. 3). Les progrès attendus en neuro-immunologie devraient permettre d’élaborer de nouvelles stratégies thérapeutiques, par exemple en utilisant des neuromodulateurs pour diriger la réponse immune de manière ciblée dans le cadre de pathologies inflammatoires ou des neuropathies.