Les vaccins thérapeutiques, un nouvel espoir contre certains cancers et certaines infections chroniques
Les vaccins thérapeutiques n’ont pas pour objectif de prévenir l’infection ou la maladie mais d’induire une réponse immunitaire contre un agent infectieux déjà présent dans l’organisme ou contre des cellules cancéreuses. La vaccination thérapeutique consiste à administrer un ou plusieurs antigènes, pour stimuler une réponse spécifique de cet antigène. En particulier, on cherche à activer une réponse à lymphocytes T cytotoxiques : s'ils sont spécifiques de l'antigène vaccinal, alors ils pourront reconnaître et éliminer les cellules tumorales ou infectées qui expriment cet antigène. La nature de l'antigène dans le contexte du cancer ou des infections chroniques sera discutée dans la suite de l'article. La forme sous laquelle l'antigène est administré peut être très diverse, ce qui sera aussi détaillé ensuite.
La vaccination thérapeutique est souvent moins efficace que celle des vaccins prophylactiques car les vaccins thérapeutiques doivent stimuler un système immunitaire souvent affaibli ou ayant développé des systèmes de tolérance ou des mécanismes inhibiteurs qui font qu’il ne réagit pas correctement. Il semble alors intéressant de combiner une vaccination et une immunothérapie complémentaire (comme par exemple les anticorps monoclonaux) pour inactiver les principaux mécanismes immunosuppresseurs.
Nous verrons tout d’abord comment les vaccins thérapeutiques peuvent permettre de lutter contre les cellules cancéreuses puis en quoi ils peuvent également être un espoir de traitement pour les infections chroniques comme l’hépatite B chronique. Une présentation de quelques exemples de stratégies vaccinales intéressantes sera réalisée et s’appuiera sur des articles montrant soit des résultats encourageants soit des perspectives possibles dans le futur , mais elle ne sera pas exhaustive.
1. Des vaccins thérapeutique contre les cancers
L’immunothérapie basée sur les anticorps est depuis plusieurs années utilisées comme traitement thérapeutique du cancer. Ces anticorps permettent de bloquer les freins du système immunitaire. Les vaccins thérapeutiques sont une autre forme d’immunothérapie basée sur l’injection d’antigènes afin de stimuler le système immunitaire.
1.1. La composition des vaccins thérapeutiques dirigés contre les cancers
Un antigène est dit tumoral s’il est issu d’un gène cellulaire qui a été muté du fait que la cellule soit cancéreuse ce qui conduit à une séquence protéique différente de la protéine de la cellule saine, on parle de soi modifié. Ce sont généralement des antigènes qui sont sur-exprimés par les cellules cancéreuses et ne sont pas exprimés par les cellules normales. Cependant ce ne sont pas toutes les tumeurs qui expriment un antigène spécifique aux cellules cancéreuses.
Les antigènes peuvent aussi être d’origine virale si le cancer est associé à une infection virale.
Les vaccins thérapeutiques contre les cancers induisent une réponse immunitaire contre ces antigènes tumoraux en apportant l’antigène de différentes façons :
- soit un antigène est produit en dehors de l'organisme et apporté directement sous forme de protéine ou de peptide ;
- soit l’antigène est apporté en association avec des cellules présentatrices de l’antigène comme les cellules dendritiques différenciées contenant des antigènes tumoraux qu’elles peuvent présenter à leur surface aux lymphocytes T ;
- soit on induit l'expression de l'antigène en transférant le gène permettant son expression, sous forme d'acide nucléique (ADN ou ARN) ;
- soit on force les antigènes tumoraux naturels à être visibles, en lysant les cellules tumorales à l'aide de virus oncolytiques.
Plusieurs types d’antigènes peuvent parfois être utilisés afin de réduire le risque de sélection de variants tumoraux n'exprimant pas l’antigène vaccinal et donc devenus insensibles à la réponse immunitaire provoquée par le vaccin. Ces vaccins contiennent aussi des adjuvants immunostimulants, comme les vaccins prophylactiques.
1.2. Des vaccins thérapeutiques « universels »
1.2.1 Un premier exemple : un vaccin dirigé contre le système vasculaire tumoral
Cette approche consiste à orienter la réponse immunitaire contre des antigènes exprimés par les cellules vasculaires tumorales. En éliminant les cellules vasculaires, on espère priver la tumeur des apports en nutriments et oxygène, indispensables à la prolifération tumorale.
Ces cellules qui composent les vaisseaux sanguins créés par la tumeur sont plus stables que les cellules de la tumeur elle-même (moins de variation des antigènes) et la vascularisation est facilement accessible pour les cellules immunitaires ou les anticorps. Ce type de vaccination déclenchera l'activation de lymphocytes T cytotoxiques responsables de la lyse des cellules vasculaires tumorales, ou la production d'anticorps qui pourront contribuer à l'élimination des cellules par un mécanisme de cytotoxicité dépendant des anticorps.
Un exemple d’antigène qui a été testé est une protéine contenant des domaines de la fibronectine, une protéine exprimée par les cellules vasculaires. De façon intéressante, certains domaines de la fibronectine ne sont exprimés qu’au cours de l’angiogenèse (formation des vaisseaux sanguins) tumorale et ne sont pas exprimés dans les vaisseaux sanguins normaux chez l’adulte (sauf de façon très transitoire pour permettre la cicatrisation) et peuvent donc être utilisés comme antigènes spécifiques du contexte tumoral.
En particulier les domaines ED-A et ED-B sont fortement exprimés par les cellules vasculaires lors de l’angiogenèse dans divers types de tumeurs. Le domaine ED-A ou ED-B constitue un autoantigène, donc les lymphocytes spécifiques de cet antigène seront des lymphocytes auto-réactifs normalement non activés (du fait des mécanismes d'auto-tolérance). Afin d’empêcher l’auto-tolérance vis-à vis de cet antigène, une protéine de fusion recombinante a été élaborée avec le domaine ED-A ou ED-B (domaine de la fibronectine) et une partie de protéine bactérienne (protéine du non-soi) appelée TRX.
Ces domaines ED-A et ED-B montrent une forte conservation de leur séquence peptidique entre les espèces. Cette conservation rend possible l’utilisation du modèle murin (même séquence pour ED-B et un acide aminé différent pour ED-A) pour expérimenter le vaccin. Afin de tester ce vaccin, le modèle de la souris MMTV-PyMT est utilisé, la souris présente un adénocarcinome mammaire métastatique, considéré comme très proche du cancer du sein humain. Un groupe de souris est vacciné avec un vaccin contenant la protéine de fusion et un groupe de souris contrôle suit le même protocole mais avec un vaccin ne contenant que la partie protéique d’origine bactérienne TRX (Figure 1).
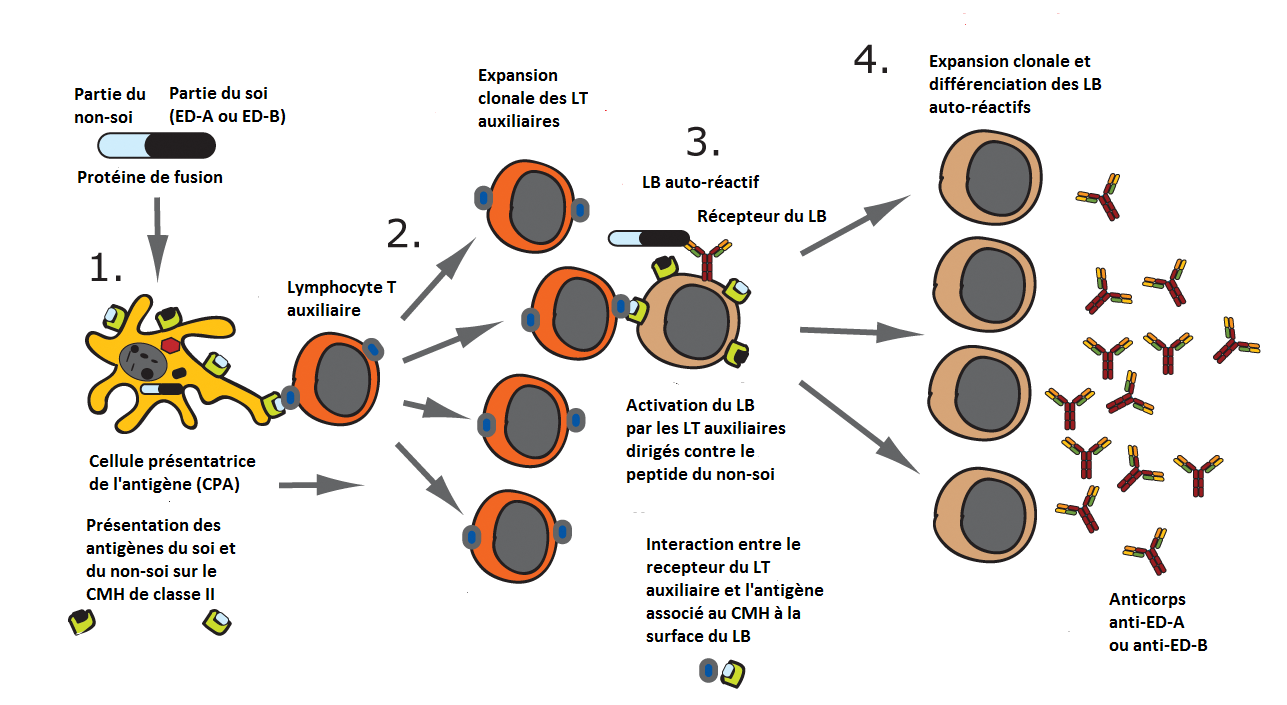
Figure 1. Schéma de la stratégie vaccinale réalisée d’après Julia Femel et al. Therapeutic vaccination against fibronectin ED-A attenuates progression of metastatic breast cancer, Oncotarget, Vol. 5, No. 23, 2014.
Dans le cas étudié, le mécanisme de la vaccination thérapeutique est le suivant : l’antigène d’origine peptique (la protéine de fusion) est injecté, il est ensuite internalisé par les cellules présentatrices de l’antigène (CPA) qui vont alors présenter la partie du soi (ED-A ou ED-B) et la partie du non-soi (peptide bactérien) à leur surface sur une molécule de CMH de classe II (1). Les lymphocytes T4 auxiliaires reconnaissent les peptides de la partie du non-soi et sont activés et vont se multiplier (2).
Des lymphocytes B auto-réactifs sont présents dans la circulation et via leur récepteur, ils reconnaissent une partie du soi de la protéine antigénique. Cela se traduit par l’internalisation et la dégradation de la protéine de fusion puis la présentation de peptides à la fois de la partie du soi et de la partie du non soi sur le CMH classe II à la surface des lymphocytes B (3). Ils pourront alors être activés par les LT auxiliaires précédents et entrent en expansion clonale puis se différencient en plasmocytes qui vont produire des anticorps dirigés contre le domaine ED-A ou ED-B de la fibronectine (4).
Ainsi, cette réponse immunitaire est réalisée par des anticorps dirigés contre le système vasculaire tumoral exprimant ED-A (ou ED-B) : les anticorps anti-ED-A (ou anti-ED-B) se lient au domaine ED-A (ou ED-B) dans les molécules de fibronectine présentes dans la matrice extracellulaire à la surface des vaisseaux. Cette liaison conduit à la formation de complexes immuns qui attireront des cellules de l’immunité innée, comme les macrophages. L’action des macrophages (la phagocytose des complexes immuns) va conduire à des lésions tissulaires au niveau des vaisseaux sanguins.
Dans l’étude présentée ici, les souris vaccinées reçoivent soit un vaccin TRX-EDA ou un vaccin contrôle TRX (contenant l’antigène TRX mais sans ED-A). Une première dose de vaccin est injectée à 5 semaines et une seconde dose de rappel à 7 semaines. Des prélèvements sanguins sont réalisés au cours du temps sur les deux groupes de souris pour déterminer le taux d’anticorps anti-EDA. A 13 semaines, les souris sont euthanasiées et la masse de la tumeur est déterminée (Figure 2).

Figure 2.
A : Chronologie des vaccinations, des examens sanguins et de la fin de l’expérimentation sur le modèle murin.
B : Taux d’anticorps anti-ED-A (dirigés contre la partie du soi, le domaine ED-A) chez le groupe ayant reçu le vaccin contrôle TRX et chez le groupe ayant reçu le vaccin TRX-EDA, dans le sang à différents temps.
C : Poids de la tumeur chez les souris contrôles (ayant reçu seulement l’antigène TRX) et les souris vaccinées avec l’antigène TRX-EDA (la protéine de fusion).
TRX indique les résultats pour le groupe contrôle et TRX-EDA ceux obtenus pour le groupe ayant reçu le vaccin TRX-EDA.
L’étoile indique une différence significative entre les deux groupes de données.
D’après Julia Femel et al. Therapeutic vaccination against fibronectin ED-A attenuates progression of metastatic breast cancer, Oncotarget, Vol. 5, No. 23, 2014.
D’après les résultats obtenus, la vaccination avec la protéine de fusion TRX-EDA induit la production d’anticorps anti-ED-A. On peut observer que la masse des tumeurs des souris vaccinées est plus faible que celle des souris témoins (figure C). La vaccination a donc permis de stopper la croissance tumorale. Cela suggère qu’une diminution de la fonction vasculaire due à la réaction immunitaire provoquée par la vaccination a conduit à une diminution du volume de la tumeur. On observe également un nombre plus réduit de métastases.
Actuellement, des essais cliniques sont en cours et il sera sans doute nécessaire de faire deux à trois vaccinations par an pour maintenir des taux suffisamment élevés d'anticorps.
Source : Julia Femel et al. Therapeutic vaccination against fibronectin ED-A attenuates progression of metastatic breast cancer, Oncotarget, Vol. 5, No. 23, 2014. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4322999/
1.2.2. Un deuxième exemple : des vaccins qui ciblent les télomérases
D’autre vaccins thérapeutiques dits universels pour lutter contre les cancers sont en cours d’essai clinique et ciblent une protéine produite par un grand nombre de cellules cancéreuses : la télomérase. La télomérase ou plus précisément sa sous-unité hTERT est une protéine fortement exprimée par les cellules cancéreuses dans plus de 85 % des cancers.
Les télomères sont des séquences d’ADN répétées qui protègent les extrémités des chromosomes. À chaque cycle cellulaire et donc réplication, les télomères se raccourcissent. Lorsqu’ils atteignent une taille critique, la réplication ne se produit plus et la cellule entre en senescence réplicative. Ce mécanisme empêche des cellules de se multiplier de façon incontrôlée en imposant un nombre de division maximal que les cellules peuvent soutenir (limite à l'immortalité cellulaire). La télomérase exprimée par les cellules cancéreuses assure le maintien de la longueur des télomères, ce qui permet de poursuivre les multiplications cellulaires : son activité confère un état immortel aux cellules.
Plusieurs vaccins dirigés contre cette protéine sont en cours d’essai. Ils existent sous plusieurs formes :
- Les vaccins peptidiques comme GV1001 qui contient un peptide antigénique de hTERT. Ce vaccin est utilisé contre le cancer du pancréas et le cancer du poumon. Il peut aussi être utilisé en association avec d’autres vaccins peptidiques contenant d’autres antigènes tumoraux. Il y a également le vaccin UV1 qui combine trois peptides dérivés de hTERT et qui lors d’un essai clinique chez des patients atteints d’un cancer métastatique de la prostate a montré des résultats positifs : 85,7 % des patients ont réagi favorablement à la vaccination et pour 45 %, la tumeur a disparu. Le vaccin UCPVax, comme les deux précédents, consiste à injecter des fragments peptides de télomérase déclenchant une réaction immunitaire, en stimulant spécifiquement les lymphocytes T CD4 qui ont un rôle central dans la réponse anti-tumorale. Ce vaccin a déjà été testé chez des personnes atteintes de cancer du poumon métastatique afin de vérifier son innocuité et son immunogénicité, c’est-à-dire de vérifier qu’il est capable d’induire la multiplication de lymphocytes T CD4 spécifiquement dirigés contre la télomérase. Les résultats ont été positifs et un essai clinique de phase II doit permettre de confirmer la bonne tolérance du vaccin et son efficacité contre le cancer du poumon. Il sera associé avec un traitement inhibant les mécanismes d’inhibition du système immunitaire : une immunothérapie anti-PD1 (la protéine PD1 étant une protéine intervenant dans un de ces mécanismes).
- Les vaccins à base de cellules dendritiques modifiées (cultivées avec l’antigène tumoral ou transfectées avec l’ARN messager de hTERT).
- Les vaccins à ADN recombinant codant pour un peptide dérivé de hTERT comme INVAC-1 qui est en phase d’essai clinique sur des patients ayant des cancers récidivistes ou réfractaires aux traitements habituels. Cet essai a donné des résultats positifs : on observe que 58 % des patients participant à l’essai ont connu une stabilisation de la maladie.
- On peut également réaliser l’injection de lymphocytes T modifiés génétiquement capables d’exprimer des récepteurs T reconnaissant l’antigène dérivé de hTERT mais on ne peut alors plus réellement parler de vaccin puisqu’on n’apporte pas l’antigène mais des lymphocytes spécifiques à l’antigène (c’est une thérapie cellulaire).
Chez la souris, il a été prouvé que ce type de vaccin thérapeutique empêche le développement des cellules cancéreuses (Figure 3).
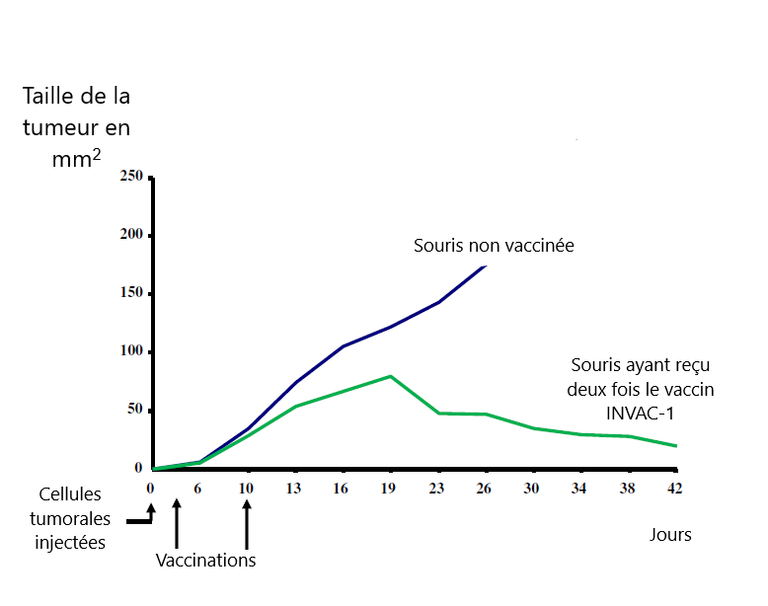
Figure 3 : Evolution de la taille de la tumeur chez des souris ayant reçu le vaccin deux fois et des souris contrôles non vaccinées. D’après Pierre Langlade-Demoyen
Le vaccin INVAC-1 est un vaccin à ADN. Il contient des plasmides, molécules circulaires d’ADN contenant la séquence génétique de la transcriptase inverse de la télomérase (hTERT). Après injection dans le derme de la peau, les plasmides sont intégrés à l’intérieur des cellules dendritiques présentes dans la peau et permettent l’expression de hTERT dans la cellule. Les cellules dendritiques peuvent ensuite se déplacer vers les ganglions lymphatiques pour présenter des peptides de hTERT aux lymphocytes T. Les lymphocytes T CD4 activés suite à la reconnaissance de l’antigène (peptide de la télomérase) se multiplient et produisent des médiateurs chimiques. L’action concertée des cellules dendritiques et des lymphocytes T CD4 permettant l’activation et la différenciation des lymphocytes T CD8 reconnaissant spécifiquement la télomérase. Les LT CD8 se multiplient puis se différencient en LT cytotoxiques qui vont détruire les cellules cancéreuses produisant la télomérase et qui présentent donc des peptides dérivés de la télomérase à leur surface (présentation par le CMH-I).

Figure 4 : Schéma explicatif du mécanisme d’action du vaccin INVAC-1
Modifié d’après https://www.invectys.com/products-pipeline/invac-1-a-dna-vaccine-targeting-cancer/#INVAC-1-Mechanism-of-action.
IFNγ : médiateurs chimiques
Sources :
- Visio-conférence de Langlade-Demoyen
- https://www.invectys.com/products-pipeline/invac-1-a-dna-vaccine-targeting-cancer/#INVAC-1-Mechanism-of-action
- Eishiro Mizukoshi et Shuichi Kaneko, Telomeras-Targeted Cancer Immunotherapy, International Journal of Molecular Sciences, 2019.
1.3. Des vaccins thérapeutiques contre le papillomavirus (HPV) pour lutter contre les cancers provoqués par son infection
Le virus HPV16 serait responsable d’environ 50 % des cancers du col de l’utérus, et HPV18 de 10 à 15 % des cas. Les vaccins préventifs contre le HPV ne suffisent pas à affecter la prévalence importante du cancer du col de l’utérus. En effet, il reste le deuxième cancer le plus fréquent chez la femme et le HPV a été reconnu comme étant impliqué dans 99,7 % des cas. Ce virus peut également être à l’origine d’autres cancers.
Afin de traiter le cancer du col de l'utérus et de traiter les infections actuelles au HPV, des vaccins thérapeutiques contre le HPV se sont donc développés.
HPV infecte les cellules basales de l'épithélium cervical (Figure 5). HPV16 exprime les protéines E2 et E5 peu de temps après le début de l’infection. Ces protéines virales induisent des mécanismes inhibant le système immunitaire et elles interviennent dans l’initiation du processus cancérogène. Les protéines E6 et E7 sont les protéines virales principalement responsables de la transformation des cellules en cellules cancéreuses, on parle de protéines transformantes. Elles se lient aux protéines codées par les gènes suppresseurs de tumeur tels que les gènes Rb (Rétinoblastome) et p53. La protéine E7 se lie au produit du gène du rétinoblastome, la protéine Rb, tandis que la protéine E6 interagit avec la protéine p53 ce qui empêche ces protéines de réaliser leur fonction (figure 6). Or les protéines Rb et p53 interviennent dans le contrôle du cycle cellulaire et donc de la division cellulaire : les cellules vont alors pouvoir se multiplier de façon indéfinie. Les protéines E6 et E7 sont les protéines virales principalement responsable de la transformation des cellules en cellules cancéreuses, on parle de protéines transformatrices. Elles inhibent des gènes suppresseurs de tumeur.

Figure 5 : Cycle viral simplifié d’HPV et progression possible vers la cancérisation au niveau de l’épithélium cervical.
D’après Denise Nardelli-Haeflger et Pierre De Grandi, Stratégies vaccinales contre le cancer du col utérin, Revue médicale suisse (2004).
Oncogènes : gènes comme les gènes de E6 ou de E7 dont l’expression favorise la transformation des cellules en cellules cancéreuses.
Dysplasie : développement de cellules anormales dans l’épithélium du col de l’utérus.

Figure 6 : Mécanisme d’action des protéines virales E6 et E7
Modifié d’après The HPV E6/E7 Oncogenes: Key Factors for Viral Carcinogenesis and Therapeutic Targets, Karin Hoppe-Seyler et al., Trends in microbiology, 2017.
Ces protéines oncogènes E6 et E7 sont exprimées par les cellules tumorales du fait de la réplication virale et jouent un rôle clef dans l’induction et le maintien de la prolifération tumorale. Ces protéines peuvent être présentées sous forme de peptides antigéniques associés aux molécules de CMH-I à la surface des cellules cancéreuses et donc constituent des antigènes tumoraux pouvant être reconnus par les lymphocytes T cytotoxiques (LTC). Elles peuvent donc être des antigènes utilisés en vaccination thérapeutique.
Il existe différents types de vaccins thérapeutiques testés dont des vaccins thérapeutiques à ADN dirigés contre les cellules cancéreuses infectées ou transformées par l’HPV. De la même façon que le vaccin INVAC-1 vu précédemment, l’ADN des vaccins a d’abord pour cible les cellules dendritiques du système immunitaire. Une fois introduit dans les cellules dendritiques, il s’exprime et permet la synthèse de peptides de E6 ou E7 ou encore E2.
- Un des candidats thérapeutiques est VGX-3100 qui utilise un mélange de deux plasmides contenant les séquences des gènes de E6 et E7 des HPV16 et HPV18 (essai réalisé en 2021). La régression de la tumeur et la production de lymphocytes T cytotoxiques anti HPV16 ou HPV18 sont plus importants chez le groupe de patientes vaccinées que chez le groupe de patientes ayant reçu un placébo.
- Un vaccin à ADN MEDI0457 a été testé en essai clinique (en 2015) sur 21 patients atteints d’un cancer oropharyngé. Ce vaccin induit une réponse immunitaire contre les protéines E6 et E7. On a pu observer une réaction immunitaire chez tous les patients au moins dirigée vers une des deux protéines. De plus cette réponse est restée importante pendant au moins 3 mois chez 18 patients.
Le deuxième type de vaccins thérapeutiques qui semble prometteur est le vaccin vivant recombinant.
- Par exemple, MVA E2, est constuit à partir d’un vecteur viral, le virus de la vaccine, exprimant l’antigène E2 du papillomavirus bovin. Lors de l’essai clinique réalisé en 2021, 89% femmes ont montré une élimination complète des lésions intraépithéliales après traitement, et 81 % des femmes ont éliminé le virus.
- Le PCPV (virus de la paravaccine des bovins) peut également être utilisé comme vecteur pour la conception de vaccins efficaces contre le cancer car il induit la production importante d’un médiateur chimique, l’IFN-alpha, par les cellules dendritiques et les monocytes. Il active ainsi l’immunité innée et réduit les mécanismes immunosuppresseurs.
Un vaccin à base de PCPV et un autre à base de MVA (virus modifié de la vaccine Ankara) codant pour la forme non oncogène de la protéine E7 d’HPV16 (les acides aminés 21 à 26 ont été supprimés) ont étés testés chez la souris. Les deux vaccins apparaissent efficaces pour induire la prolifération de LT CD8 spécifiquement dirigés contre l’antigène E7. L'injection de PCPV-E7 dans des tumeurs palpables chez la souris, suivie d'une injection intraveineuse de MVA-E7, a entraîné une augmentation significative du taux de survie, souvent accompagnée d'une régression tumorale complète. Cette vaccination hétérologue (avec 2 types de vaccins différents) s’avère plus efficace qu’avec 2 vaccination MVA-E7. Mais il y a encore des tests de sécurité à réaliser avant de le tester directement sur l’Homme.
Des vaccins peptidiques (peptides dérivés de E7 et E6) sont également en cours d’essai ainsi que des vaccins à bases de cellules dendritiques.
1.4. Conclusion sur les vaccins thérapeutiques dirigés contre les cancers
Même si les résultats observés chez la souris sont très encourageants, les résultats en essais cliniques sont moins concluants en particulier si le stade du cancer est avancé. En effet, au cours de l’évolution du cancer, différents mécanismes se mettent en place pour échapper au système immunitaire :
- les cellules tumorales ne vont pas exprimer de molécules de CMH de classe I permettant la présentation des antigènes à leur surface ce qui leur permet de ne pas être reconnues par le système immunitaire ;
- la tumeur va produire des médiateurs chimiques immunosuppresseurs ;
- les cellules cancéreuses vont stimuler les lymphocytes T régulateurs qui inhibent les cellules tueuses antitumorales.
Ainsi plus le stade du cancer est avancé, plus il est difficile de stimuler une réponse immunitaire efficace avec la vaccination. Cependant des essais cliniques réalisées sur des patients ayant des lésions cancéreuses précoces présentent davantage de résultats positifs.
Sources :
- Tang, J.; Li, M.; Zhao, C.; Shen, D.; Liu, L.; Zhang, X.;Wei, L. Therapeutic DNA Vaccines against HPV-RelatedMalignancies: Promising Leads from Clinical Trials. Viruses 2022, 14, 239. https://doi.org/10.3390/v14020239
- Aggarwal and Al, Quot. Médecin 24/09/2018 (à paraître dans Clinical Cancer Research)
https://www.labovialle.com/archives/325-articles-parus-en-2018/713-resultats-prometteurs-pour-un-vaccin-therapeutique-dans-les-cancers-oro-pharynges-ebv-induits
- Rodrigo Nalio Ramos et al., Pseudocowpox virus, a novel vector to enhance the therapeutic efficacy of antitumor vaccination, Immunology 2022, https://www.mdpi.com/2073-4409/9/9/2103/htm
- Denise Nardelli-Haeflger et Pierre De Grandi, Stratégies vaccinales contre le cancer du col utérin, Revue médicale suisse (2004).
- J.Michels, P.Pautier, C.Lhommé, Vaccination thérapeutique dans les cancers du col utérin, la lettre du cancérologue, Vol.XX-n°8, 2011.
- The HPV E6/E7 Oncogenes: Key Factors for Viral Carcinogenesis and Therapeutic Targets, Karin Hoppe-Seyler et al., Trends in microbiology, 2017.
2. La vaccination thérapeutique pour lutter contre les infections chroniques
Un virus thérapeutique contre le virus de l’hépatite B ?
L’ infection chronique par le virus de l’hépatite B (VHB) touche exclusivement les hépatocytes et peut conduire à une cirrhose ou un cancer du foie. Dans le cas d’une infection par le VHB, une forte réponse immunitaire est nécessaire pour éliminer le virus. Mais dans le cas de l’infection chronique, la réponse immunitaire et affaiblie et ne suffit pas à éliminer le virus en particulier la réponse immunitaire des LT8 est dysfonctionnelle.
Il a alors été proposé un vaccin thérapeutique pour traiter l’infection chronique par le VHB en stimulant la réponse immunitaire spécifique dirigée contre le virus car le dysfonctionnement des lymphocytes T n'est pas irréversible. Cependant même avec une vaccination thérapeutique, on observe un épuisement de la réponse immunitaire ce qui explique le succès limité de cette vaccination.
On observer un épuisement immunitaire :
- en lien avec la persistance virale
- en lien avec la difficulté de stimuler une réponse des lymphocytes T par la vaccination thérapeutique.
Cet épuisement est observé pour les infections chroniques comme les infections liées au VHB chez l’Homme et au virus de la chorioméningite lymphocytaire chez la souris (LCMV). Cet épuisement peut être dû au fait que lorsque les lymphocytes T sont stimulés de façon chronique par le même antigène, ce qui est le cas lors d’une infection chronique (ou des cancers), ils vont exprimer de façon plus importante des molécules intervenant dans des mécanismes inhibiteurs comme la protéine PD1. Lorsque la protéine PD1 se lie à son ligand (PD-L1) cela inhibe les fonctions du lymphocyte. Il en résulte une perte de la fonctionnalité de ces cellules (on parle d’état d’épuisement) ou une mort programmée des lymphocytes. C’est pourquoi on cherche à développer des traitements d’immunothérapie visant à empêcher la liaison entre PD1 et son ligand pour les combiner à la vaccination thérapeutique.

Figure 7 : Mécanisme de liaison moléculaire entre PD-1 et PD-L1 inhibant la cellule immunitaire et effet des traitements bloquant cette liaison.
Modifié d’après https://www.e-cancer.fr/Patients-et-proches/Se-faire-soigner/Traitements/Therapies-ciblees-et-immunotherapie-specifique/Immunotherapie-mode-d-action
Une étude a été réalisée chez la souris atteinte d’une infection chronique par le LCMV sur l’impact du blocage des signaux inhibiteurs engendrés par la liaison PD/PD-L1 en combinaison avec une vaccination thérapeutique. Des souris infectées de manière persistante par le LCMV ont été vaccinées avec un vaccin recombinant composé du virus de la vaccine exprimant l'antigène LCMV gp 33-41 spécifique du virus LCMV, et traitées avec des anticorps bloquant PD-L1. Les souris ont été vaccinées quatre semaines après l’infection puis traitées avec les anticorps anti-PD-L1. Deux semaines après le traitement, une augmentation significative des lymphocytes T CD8+ dirigés contre les antigènes spécifiques au virus présents dans le vaccin a été observée, comparativement aux souris qui n’avaient reçu que la vaccination. De plus, on observe que l’élimination du virus est favorisée : une diminution plus importante de la charge virale deux semaines après le traitement est observée.

Figure 8 : Nombre de lymphocytes T CD8+ spécifiques à l’antigène GP33 dans différents tissus (deux semaines après traitement pour les souris qui l’on reçu).
Modifié d’après Sang-Jun Ha et al. Enhancing therapeutic vaccination by blocking PD-1 – mediated inhibitory signals during chronic infection, The Journal of Experimental Medicine, 2008.
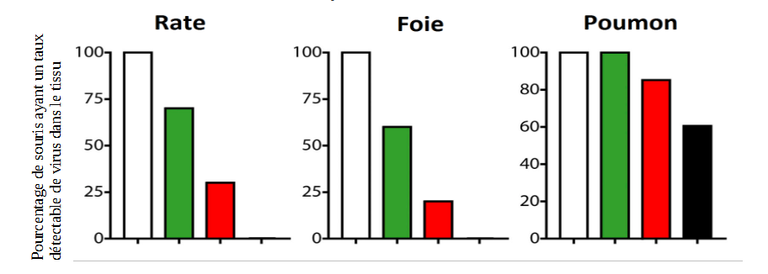
Figure 9 : Pourcentage de souris ayant un taux détectable de virus pour différents organes testés.
Blanc : Souris non vaccinées et sans traitement anti-PD-L1. Vert : Souris vaccinées sans traitement anti-PD-L1. Rouge : Souris non vaccinées mais ayant reçu le traitement anti-PD-L1. Noir : Souris vaccinées ayant reçu le traitement anti-PD-L1.
Modifié d’après Sang-Jun Ha et al. Enhancing therapeutic vaccination by blocking PD-1 – mediated inhibitory signals during chronic infection, The Journal of Experimental Medicine, 2008.
De plus, l’expression de PD-1 sur les lymphocytes T CD8+ spécifiques de GP33 a été fortement régulée à la baisse dans la rate, le foie et les poumons chez des souris traitées avec le vaccin combiné au traitement anti-PD-L1, en comparaison avec les souris non vaccinées. Or on sait que l’augmentation de l'expression de PD-1 sur les lymphocytes T CD8+ pendant l'infection chronique est associée à la susceptibilité à l'apoptose (mort cellulaire programmée) lors de la stimulation du récepteur TCR spécifique de l'antigène. Ainsi le blocage de PD-L1 par le traitement pourrait diminuer le nombre de LT CD8+ entrant en apoptose. Il apparaît également que la combinaison de la vaccination thérapeutique et du blocage de PD-L1 améliore plus efficacement la réponse des LT CD8+ et le contrôle viral que le blocage de PD-L1 seul.
Il reste à expliquer cette synergie entre la vaccination thérapeutique et le traitement anti-PD-L1 alors que la vaccination à elle seule semble inefficace. Une hypothèse serait que les cellules présentatrices de l’antigène après vaccination thérapeutique présentent de façon plus efficace les antigènes. Des cellules dendritiques isolées des souris ont été cultivées avec des LT CD8+ spécifiques de l’antigène du vaccin et les résultats montrent une prolifération plus importante de LT CD8+ en présence des cellules dendritiques issues des souris ayant reçu la vaccination et le traitement, ce qui suggère que les cellules dendritiques présentent l’antigène de façon plus efficace après la vaccination thérapeutique ce qui renforce l’activation des LT CD8+ spécifiques de l’antigène. On observe donc une amélioration de manière synergique des réponses fonctionnelles des lymphocytes T CD8+ et de l’élimination du virus chez la souris.
Pour conclure, il apparaît intéressant de bloquer les mécanismes immunosuppresseurs pour augmenter l’efficacité de la vaccination thérapeutique.
Sources :
- Tamsin Cargill et Eleanor Barnes, Therapeutic vaccination for treatment of chronic hepatitis B, Immunology review, 2021. https://academic.oup.com/cei/article/205/2/106/6431044?login=true
- Sang-Jun Ha et al. Enhancing therapeutic vaccination by blocking PD-1 – mediated inhibitory signals during chronic infection, The Journal of Experimental Medicine, 2008.
