La spectroscopie infrarouge (I.R.)
Le principe de cette spectroscopie est semblable à celui de la spectrophotométrie dans le visible. L'analyse des radiations absorbées permet d'identifier les transitions entre niveaux d'énergie et d'en déduire des informations sur la structure de la molécule. Dans le visible (mais aussi dans l'UV), les radiations absorbées correspondent à des transitions entre niveaux d'énergie électroniques.
- Vibration d'une molécule diatomique :
On considère une molécule constituée par 2 atomes A et B. Soit r la distance qui sépare les deux noyaux atomiques (distance internucléaire). La courbe ci-dessous (courbe de Morse) présente les variations de l'énergie potentielle du système formé par ces deux atomes en fonction de la distance r. Le minimum correspond à la distance internucléaire d'équilibre notée re.
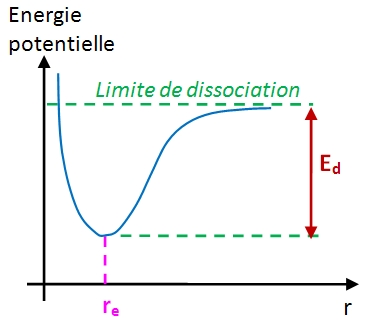
Le système formé par les deux atomes peut être considéré comme un oscillateur harmonique (une sorte de ressort de raideur k reliant les deux atomes) dont on peut calculer la fréquence propre d'oscillation notée v. Cette fréquence dépend de la masse réduite du système µ et de la force de la liaison interatomique. Elle est donnée par la loi de Hooke :
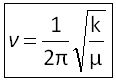 avec
avec 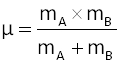
Lorsqu'une onde électromagnétique est en interaction avec la molécule diatomique, de l'énergie est absorbée. L'oscillateur est excité et les atomes vibrent avec la même fréquence autour de leur position d'équilibre. La molécule est en vibration d'élongation (étirement de la liaison A-B). Cette vibration de la molécule est appelée mode normal de vibration. La fréquence du quantum d'énergie absorbé est donnée par la loi de Hooke. Ce qui permet de déterminer la longueur d'onde de la radiation absorbée :
Longueur d'onde : 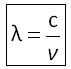 avec c : vitesse de la lumière
avec c : vitesse de la lumière
En spectroscopie, plutôt que d'utiliser la longueur d'onde ou la fréquence, on préfère utiliser l'inverse de la longueur d’onde appelé nombre d’onde et exprimé en cm-1.
Nombre d'onde : 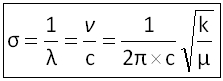
Ces grandeurs étant caractéristiques de la molécule, en analysant des radiations absorbées par l’échantillon on peut donc identifier les transitions entre niveaux d'énergie et en déduire des informations sur la structure de cette molécule.
- Vibration d'une molécule polyatomique :
L’absorption infrarouge par une molécule polyatomique se traduit par deux types de vibration : la vibration d’élongation (vue précédemment) et la vibration de déformation (variation d’un angle de valence).
Une molécule peut être modélisée comme un ensemble d’oscillateurs couplés mécaniquement. Lorsqu'une radiation I.R. excite un des oscillateurs, tous les oscillateurs sont excités en même temps. De fait, les atomes de la molécules vont donc vibrer autour de leur position d'équilibre avec la même fréquence. On dénombrera donc plusieurs modes normaux de vibration correspondant chacun aux vibrations d’ensemble de la molécule.
Soit une molécule possédant N atomes. Il faut 3N coordonnées pour repérer les différentes positions des atomes de cette molécule (on dit qu'elle possède 3 N degrés de liberté). On aura donc au maximum 3 N - 6 modes de vibrations normaux. En effet, sur les 3 N degrés de liberté, 3 sont utilisés pour repérer la translation du centre d'inertie de la molécule, et 3 pour repérer les rotations du système autour de celui-ci.
Exemples :
Pour une molécule coudée comme H2O (N = 3) : il y aura 3 modes de vibrations normaux soit 3 fréquences de vibration possibles.
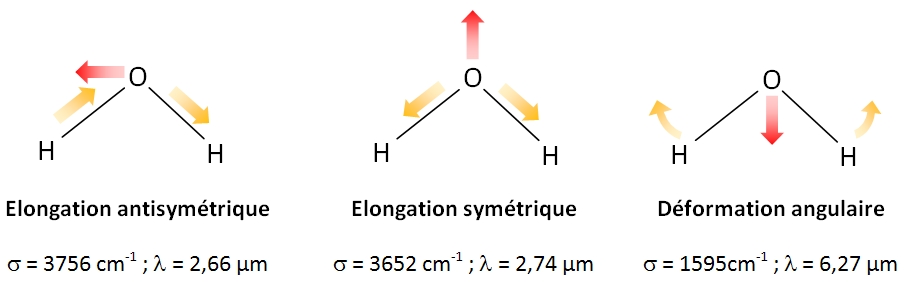
- les vibrations d'élongation symétriques : les atomes liés s'approchent ou s'éloignent de façon symétrique ;
- les vibrations d'élongation antisymétriques : de même mais cette fois-ci lorsqu'une liaison est comprimée, l'autre est étirée ;
- les vibrations de déformation d'angle.
Pour une molécule linéaire comme CO2 (N=3) : 2 angles suffisent à décrire sa rotation (la rotation autour de l'axe de la molécule n'a pas de signification physique). Il y a donc 3 N - 5 modes de vibrations normaux soit ici 4 mouvements de vibration indépendants.
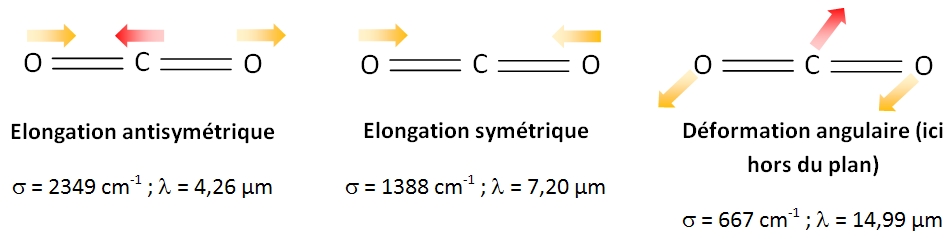
- les vibrations d'élongation symétriques : l'atome de carbone est entraîné vers l'un ou l'autre atome d'oxygène ;
- les vibrations d'élongation antisymétriques : les deux atomes d'oxygène ont des mouvements dans le même sens contrairement au mouvement de l'atome de carbone ;
- les vibrations de déformation d'angle dans le plan : les deux atomes d'oxygène ont des mouvements dans le même sens contrairement à l'atome de carbone; les liaisons ne sont plus alors parallèles ;
- les vibrations de déformation d'angle hors du plan (même description que ci-dessus mais hors du plan).
- Excitation d'une molécule : allure du spectre
Un spectre infrarouge représente l'évolution la transmittance de l'échantillon (c'est la fraction de l'intensité transmise par rapport à l'intensité incidente en pourcentage) en fonction du nombre d'onde (inverse de la longueur d'onde) ou de la longueur d'onde.
Le spectre d'absorption résultant de l'excitation de la molécule par une onde EM, présente des raies situées autour des longueurs d'onde caractéristiques des modes de vibration de la molécule.
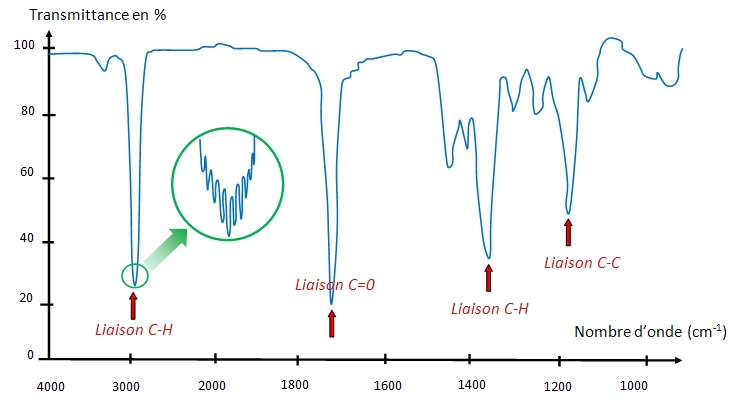
Exemple : le spectre IR d'une cétone
En observant le spectre de plus près, on remarque que les raies se subdivisent en un grand nombre de raies très rapprochées. On parle alors de spectre de bandes. Cela est dû au fait qu’aux transitions de vibration se superposent les transitions de rotation. En effet, une molécule possède des axes normaux de rotation. Or une transition vibrationnelle nécessite plus d'énergie qu'une transition rotationnelle. Se produisant, elle va modifier la longueur de la liaison ce qui entraîne une modification de la vitesse de la rotation de la molécule. Aussi l'onde EM excitatrice provoquera-t-elle, pour chaque transition vibrationnelle, une multitude de transitions rotationnelles, qui vont donner au pic de transition vibrationnelle l’allure d’une bande d’absorption : On parle alors de spectre de vibration-rotation.

