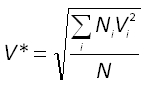Vitesse quadratique moyenne
Soit un gaz parfait constitué de molécules toutes identiques. Chaque molécule possède sa propre vitesse. La probabilité pour qu'une molécule ait une vitesse comprise entre V et V+dV est donnée par loi de distribution des vitesses de Maxwell. Cette probabilité ne dépend ni de la position de la molécule ni du temps, car le gaz est en équilibre statistique. En considérant que la vitesse est isotrope (ce qui signifie que toutes les directions des vecteurs vitesse sont équiprobables), cette probabilité ne dépend que de la norme de la vitesse. La courbe illustrant la distribution des vitesses est une courbe de Gauss.
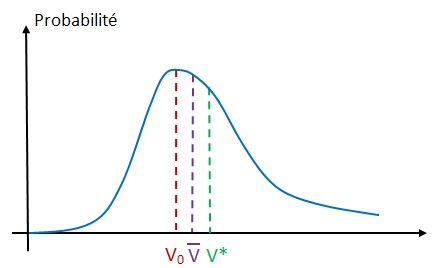
V0 est la vitesse la plus probable. C'est le maximum de la courbe.
![]() est la vitesse moyenne. C'est la moyenne des normes des vitesses. Si on considère un gaz parfait constitué de N molécules identiques et si Ni représente le nombre de molécule possédant la vitesse Vi alors :
est la vitesse moyenne. C'est la moyenne des normes des vitesses. Si on considère un gaz parfait constitué de N molécules identiques et si Ni représente le nombre de molécule possédant la vitesse Vi alors :
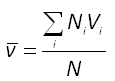
V* est la vitesse quadratique moyenne. Le terme quadratique fait référence au carré. La vitesse quadratique moyenne au carré est la moyenne des carrés de la vitesse à tout instant. C'est une grandeur physiquement plus significative car elle est liée à l'énergie cinétique de la molécule (<ec> = 1/2 m V*²).