Aspects génétiques de la maladie d'Alzheimer
Les formes familiales :
Moins de 1 % des malades présentent une maladie d'Alzheimer d'origine purement génétique. Les formes familiales présentent les mêmes caractétistiques anatomopathologiques que celles des cas sporadiques : plaques séniles dont le constituant majeur est le peptide Aß et dégénérescences neurofibrillaires dont le constituant majeur et la protéine Tau.
Cette forme familiale se caractérise par :
- l'apparition des signes avant 60 ans ;
- une transmission autosomique dominante (la moitié de chaque génération est atteinte).
Deux gènes sont impliqués :
- une mutation du gène APP situé sur le chromosome 21 qui code un précurseur de la protéine amyloïde (cinq mutations du codon 717 sont connues) ;
- une mutation du gène PSEN1 (présénilines 1) situé sur le chromosome 14 (nombreuses mutations qui sont des mutations faux-sens).
- une mutation du gène PSEN2 (présénilines 2) qui sont exceptionnelles.
La conséquence commune des mutations sur ces gènes APP, PS1, PS2 est une augmentation de la production du peptide ß.
Qu'est-ce que la préséniline?
En 1995, le gène préséniline-1 ( PS1 ) fut identifié et associé au développement d’une forme familiale de la maladie d’Alzheimer lorsque il est muté (Sherrington, Rogaev et al. 1995). À ce jour, plus de 100 mutations différentes sont identifiées dans le gène PS1 . Elles sont dominantes, fréquentes (environ 80 % de tous les cas familiaux connus) et conduisent à une forme très agressive de la maladie, affectant les individus entre 24-50 ans.
Peu de temps après la découverte de PS1 , le gène préséniline-2 ( PS2 ) fut isolé et caractérisé (Rogaev, Sherrington et al. 1995; Sherrington, Froelich et al. 1996). En fait, l’identification de PS2 reposa sur sa forte homologie avec PS1 (67% chez l’humain). Contrairement à PS1 , les mutations dans le gène PS2 sont rares (9 mutations identifiées) et associées à une forme familiale moins agressive (entre 40-70 ans).
Dans la cellule, la protéine PS1 est principalement localisée dans les membranes intracellulaires de l’enveloppe périnucléaire, du réticulum endoplasmique (RE), et de l’appareil de Golgi (Walter, Capell et al. 1996; De Strooper, Beullens et al. 1997), dans certaines vésicules intracytoplasmiques (ex : lysosomes) (Pasternak, Bagshaw et al. 2003) et dans la membrane cytoplasmique (surface membranaire) (Kaether, Lammich et al. 2002). Des études immuno-histologiques sur des cerveaux ont démontré que la protéine PS1 est présente de façon prédominante dans les neurones (Kovacs, Fausett et al. 1996) et les cellules gliales (Lah, Heilman et al. 1997).
|
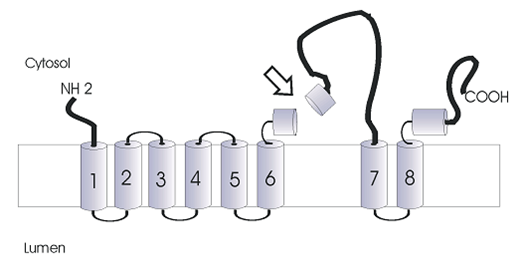
Structure de la PS1. Schéma (non à l’échelle) de la protéine préséniline-1 avec ses huit (8) domaines transmembranaires et deux domaines hydrophobes rattachés à la membrane. La flèche représente le site de clivage endoprotéolytique (a.a. 292-298) de la PS1 effectué par la « présénilinase ». |
|
Lien entre la PS1 et la maladie d'Alzheimer
Des recherche intensives au cours des dernières années ont permis de suggérer que l’activité gamma-secrétase (enzyme active donnant le peptide Aß présent dans les plaques séniles) est en fait assurée par un large complexe protéique multimérique, appelé complexe gamma-secrétase. De multiples protéines membranaires participent à sa formation, parmi lesquelles la Nicastrine, l’Aph-1, la Pen-2 et finalement les présénilines-1 et -2.
Une des premières évidences associant PS1 à un rôle physiologique précis ont été obtenues à partir des souris nulles (« knock-out ») pour la PS1 (De Strooper, Saftig et al. 1998). En bref, leur étude montre que les cellules dérivées de ces souris « knock-out » ne présentent pas d’activité gamma-secrétase et, par conséquent, pas d’accumulation de peptides Aß (ni Aß40 ou Aß42), donc pas de plaques séniles.
Toutes les mutations retrouvées dans PS1 affectent le clivage gamma-secrétase de façon à favoriser la production du peptide Aß42 neurotoxique (par rapport à Aß40). Ses observations, basées principalement sur des techniques d’immunobuvardage et d’ELISA (« Enzyme-Linked Immunosorbent Assay »), ont été reportées dans plusieurs types de cellules ainsi que dans le cerveau de souris transgéniques surexprimant une PS1 mutée.
les formes sporadiques c'est-à-dire non familiales:
L’apolipoprotéine E (ApoE) : facteur semblant favoriser la formation des fibres amyloïdes :
Les formes dites sporadiques, c'est-à-dire non familiales, comportent également une prédisposition génétique.
Rappel (cf les plaques amyloïdes):
Dans la plaque amyloïde, plusieurs constituants mineurs ont été identifiés dont l’apolipoprotéine E. L'apolipoprotéine E (ApoE) se fixe fortement au peptide amyloïde Aß, ce qui semble favoriser la formation des fibres amyloïdes. De ce fait, l'apoE peut être considérée comme un co-facteur de l'amyloïdogénèse.
Le gène de l'ApoE situé sur le chromosome 19 présente un polymorphisme représenté principalement par les allèles e3 (=APOE3), e4(=APOE4) et e2(=APOE2). Le premier se rencontre dans 51% de la population, le deuxième se rencontre dans 80 % de la population et le troisième se rencontre dans 15 % de la population ;
C'est l'existence, découverte en 1993, de l' APOE4 soit l'allèle 4 du gène de l'apolipoprotéine E qui est significativement liée à une augmentation de risque de la maladie d'Alzheimer . De nombreuses équipes ont confirmé que l'allèle e4 de l'apolipoprotéine E est de 2 à 4 fois plus fréquent chez les patients Alzheimer que dans la population générale, tandis que l'allèle e2 semble avoir un effet protecteur. L'allèle e4 de l'apolipoprotéine E est donc un facteur de risque important de la maladie d'Alzheimer (Saunders et al, 1993). Cependant, à l'échelle individuelle, le fait d'avoir un génotype epsilon4 ne peut pas être utilisé pour affirmer le diagnostic puisque tous les individus présentant cet allèle ne développent pas une maladie d'Alzheimer. D'autres études montrent que la présence de l' APOE4 sous la forme hétérozygote augmente par 2 le risque de maladie d'Alzheimer ; la présence de l' APOE4 sous la forme homozygote augmente par 11 le risque de maladie d'Alzheimer. Cette apolipoprotéine E interviendrait dans les mécanismes de réparation neuronale.
L'ensemble de ces résultats démontre que la maladie d'Alzheimer est multigénique et que l'amyloïdogénèse est le primum movens de l'affection.