Mise en culture des motoneurones
Ecrit par Jean-Pierre Ternaux
DEPOT DES MOTONEURONES
Après purification des motoneurones embryonnaires, le culot de motoneurones est repris dans un faible volume de milieu de culture. Une goutte de la suspension est placée sur une cellule de Malassez (1µl) et le nombre de motoneurones contenu dans le volume de la cellule est déterminé par comptage sous microscope (grossissement : x 150).
A l'issue de ce comptage, le nombre de motoneurones total est calculé et le volume de milieu est ajusté de façon à obtenir des densités cellulaires correspondant à 5000 ou
10 000 motoneurones, pour 60 µl de milieu.
Ces densités sont suffisantes pour obtenir des cultures viables où les motoneurones sont suffisamment éloignés les uns des autres pour pratiquer une analyse morphométrique.
Les motoneurones purifiés peuvent être cultivés sur le fond de boîte de Petri traitées pour la culture de cellule.
Dans la plupart des cas et pour faciliter la manipulation des cultures pour mettre en œuvre des techniques d'immunohistochimie ou une approche électrophysiologique, les motoneurones sont cultivés sur des lamelles de verre (12 x 24 mm, épaisseur: 1,2 à 1,4 mm).
Les lamelles de verre avant utilisation, sont tout d'abord dégraissées, traitées à l'acide sulfurique et stérilisé à sec (1heure à 160 °C). Elles sont ensuite immergées dans une solution de poly-L-lysine (0,005 % dans H2O, 24 heures), séchées puis recouvertes d'une solution de laminine (0,001 % dans du tampon phosphate de sodium, 24 heures).
Ces deux traitements successifs assurent une adhésion optimale des cellules nerveuses sur le substrat de verre. Les lamelles traitées sont disposées dans des boîtes de Petri de 35 mm de diamètre. 60 µl de la suspension de motoneurones dans le milieu de culture, contenant 5000 ou 10000 motoneurones sont déposés au centre de la lamelle de verre. Les boîtes contenant les lamelles sont alors placées dans un incubateur humide, à 37 °C en présence de 5 % ce CO2.
L'adhésion maximale des motoneurones est réalisée après 20 à 30 min. A ce stade les boites de Petri sont complétées avec 2 ml de milieu de culture et replacées dans l'incubateur.
MILIEUX DE CULTURE.
Le développement optimal des motoneurones embryonnaires en culture peut être obtenu dans des milieux définis de composition proches. C'est le cas par exemple des milieux DMEM / F12 ( Dulbecco Minimum Essential Medium / milieu F 12 : V/V) avec additifs : sodium sélénite, transférine humaine et insuline ou du milieu NeuroBasal et supplément B27 qui sont fabriqués par Gibco Brl.
L'osmolarité de ces milieux varie de 280 mOsM à 310 mOsM. Ces deux milieux contiennent du bicarbonate de sodium. Le pH du milieu est maintenu à 7, 4 en présence de 5 % de CO2.
Les milieux utilisés contiennent du rouge de Phenol comme indicateur de pH. L'acidification du milieu se traduit par un changement de couleur du milieu qui tend alors vers le jaune. Un milieu trop basique exhibe une coloration pourpre.
En fonction des expériences réalisées sur ces culture, le milieu est renouvelé chaque jour ou tous les trois jours. Quelques soient les manœuvres effectuées: addition de substances pharmacologiques, mise en place d'insert contenant d'autres types cellulaires etc… les cultures traitées sont comparées à des cultures contrôles maintenues en présence du seul milieu "défini".
IDENTIFICATION DES MOTONEURONES EN CULTURE
Les lamelles de culture, après dépôt des motoneurones peuvent être prélevées à différents stades du développement in vitro.
Après fixation des cultures dans une solution de paraformaldéhyde (3 % dans un tampon phosphate de sodium), différents anticorps peuvent être utilisés pour caractériser les motoneurones: anti ACh, anti ChAT, anti AChE, anti NSE, anti Islet I, etc…
Ces marqueurs peuvent être révélés par un anticorps secondaire couplé, par exemple, à une molécule de peroxydase ou un fluorophore (fluoresceïne, rhodamine, etc…).
Après 4 à 5 jours de culture, les prolongements neuritiques peuvent être spécifiquement identifiés comme appartenant à la catégorie des dendrites ou à celle des axones en utilisant des anticorps spécifiques dirigés contre les molécules de "Microtubule Associated Proteins" (MAPs) qui sont exprimées de façon sélective dans les deux types de prolongements.
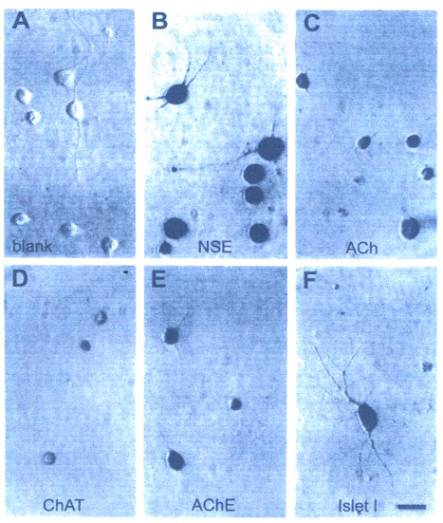 |
Identification des motoneurones en culture
Les cultures de motoneurones purifiés ont été maintenues pendant 24 heures . Les lamelles de verre ont été fixées avec de la paraformaldéhyde et plusieurs anticorps spécifiques des ont été utilisés pour mettre en évidence les motoneurones. Dans chaque cas, un second anticorps couplé à la peroxydase a été utilisé pour caractériser le marquage spécifique (précipité brun)
|
OBSERVATION DES MOTONEURONES DANS LES CULTURES
Les boîtes de Pétri contenant les lamelles de verre utilisées comme substrat de culture pour les motoneurones sont transférées de l’incubateur sur la platine d’un microscope inversé.
La visualisation des cellules présentes sur la lamelle de verre nécessite l’utilisation de condenseurs spécifiques permettant l’obtention d’un contraste suffisant pour distinguer les neurones.
En contraste de phase, les corps cellulaires des motoneurones (qui sont constitués de demi sphères) apparaissent sous forme de cercles ou d’ovales très réfringents.
Les prolongements sont visibles en noir sur fond blanc.
L’utilisation du contraste d’Hofmann permet d’obtenir une image qui rend compte du relief.
Dans ces deux conditions d’observation, qui nécessitent l’utilisation d’objectifs spécifiques pour le deux méthodes des grossissement de x 150 à x 600, peuvent être utilisés. Le microscope inversé est en outre équipé d’un système photographique (24 x 36) et d’une sortie équipée d’une caméra vidéo permettant une observation directe des neurones en culture sur un écran vidéo.
Le système vidéo est couplé à une imprimante vidéo qui permet d’obtenir des documents de travail , utilisé par la suite pour quantifier la survie et le développement morphologique des motoneurones.
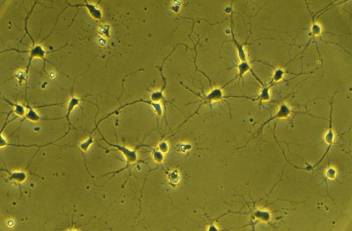 |
Culture de motoneurons spinaux embryonnaires
Les motoneurones ont été purifiés par la méthode du gradient de Nycodenz. 5000 motoneurones ont été déposés sur une lamelle de verre préalablement traitée avec de la Poly-L-lysine, puis de la laminine. Observation en microscopie en contraste de phase à 9 jours de culture. Les neurites se sont développées et les motoneurones forment un réseau. Echelle : 20 µm. |
Voir la technique de co-culture de motoneurones en présence de myoblastes
