10. Des femelles mutées qui deviennent mâles...
Un exemple d'inversion sexuelle chez les chèvres
et une autre théorie du sexe!
Lien vers le document original
|
|
...si femelle est le "sexe par défaut",
comment expliquer que des "femelles mutées" deviennent mâles?
Synthèse rédigée par Françoise Jauzein et relue par Eric Pailhoux,
d'après les articles :
"Ontogenesis of Female-to-Male Sex-Reversal in XX Polled Goats"
E. Pailhoux, B. Vigier, D. Vaiman, N. Servel, S. Chaffaux, E. Cribiu and C. Cotinot, INRA de Jouy en Josas
in Developmental Dynamics, 224:39-50, 2002
"Contribution of Domestics Animals to the Identification of New Genes Involved in Sex Determination"
E. Pailhoux, B. Vigier, D. Vaiman, L. Schibler, A. Vaiman, E. Cribiu, C. Nezer, M. Georges, J. Sundström, L. J. Pelliniemi, M. Fellous and C. Cotinot, INRA de Jouy en Josas
in Journal of Experimental Zoology, 290:700-708, 2001
"A 11.7-kb deletion triggers intersexuality and polledness in goats"
E. Pailhoux, B.Vigier, S. Chaffaux, N. Servel, S. Taourit, J-P. Furet, M. Fellous, F. Grosclaude, E. Cribiu, C. Cotinot and D. Vaiman, INRA de Jouy en Josas
Nature Genetics, 29:453-458, 2001
"Progrès des connaissances génétiques sur l'intersexualité associée à l'absence de cornes chez la chèvre d'origine alpine"
J-J. Lauvergne, INRA, station centrale de Jouy en Josas
in Ann. Génét. Sél. anim.,1(4): 403-412, 1969
Contexte
Chez les mammifères, des inversions sexuelles ont étét décrites dans de nombreuses espèces: les humains, les porcs, les chèvres, les cheveaux, les chiens, les souris, les marsupiaux et les taupes.
Deux types principaux d'inversion sexuelle existent
-des individus XY qui deviennent des hermaphrodites ou des femelles
-des individus XX qui présentent un phénotype ambigu ou mâle
Certains de ces individus présentent une mutation du gène SRY ou une translocation du gène SRY sur un des chromosome X (90% des hommes XX). Cependant, la majorité des individus inversés sexuellement possèdent des altérations de gènes liés à l'X ou autosomaux. Certains de ces gènes ont été identifiés, comme DAX1, WT1 et SOX9 et d'autres ne sont connus que sous forme de "région génétique impliquée" et restent à découvrir.
Des résultats majeurs dans ce domaine ont été obtenus pour les cas d'inversion sexuelle de sujet XY, mais aucun gène autosomal n'a encore été mis en évidence dans les cas d'inversion sexuelle chez des individus XX. C'est pourquoi l'études des animaux domestiques présentant des inversions sexuelles spontanées chez des individus XX est intéressante et contribue à la connaissance des modalités du déterminisme sexuel.
Historique du gène p
Chez les chèvres domestiques, le caractère "motte" ou "sans-corne" est connu depuis longtemps (dès la fin du XIX siècle). Ce caractère qui s'accompagne d'une plus grande prolificité, proviendrait de souches suisses de chèvres et a été répandu par sélection avec élimination des animaux "cornus" des élevages.
Ce caractère est étroitement associé à un autre, relatif aux capacités de reproduction, et qui s'exprime sous différents aspects: intersexualité, formes variées de stérilité chez les mâles, décalage du sex-ratio en faveur des mâles, surfécondité de certaines femelles.
En ce qui concerne le caractère "sans corne" la mutation est dominante (un programme anglais d'éradication des reproducteurs cornus commencé en 1932 ne permit pas d'éliminer ce caractère et il restait encore 40% de chevreaux cornus en 1941).
En ce qui concerne l'intersexualité, elle est, depuis les années 30, considérée comme monofactorielle récessive (mais à l'époque, l'étude du déterminisme génétique du sexe des animaux concernés n'était pas envisageable).
C'est au début des années 40 que l'idée selon laquelle "absence de cornes et intersexualité" ont un déterminisme factoriel associé se fait jour. Une enquête révèle en effet que tous les intersexués sont dépourvus de cornes. Une explication est proposée: le gène dominant pour l'absence de cornes serait étroitement lié au gène récessif d'intersexualité, et son auteur précise (en se basant sur le fait qu''il existe un déficit considérable de femelles dans les troupeaux sans cornes) que les intersexués doivent être des femelles XX.
Puis, en 1944, l'hypothèse s'affine: puisque malgré les générations successives qui naissent on ne peut pas séparer les souches présentant seulement de l'intersexualité de souches sans cornes, les deux caractères doivent être gouvernés par un seul et même gène, pléiotropique.
Le gène p ("polled") présente donc deux allèles: p récessif est l'allèle sauvage qui gouverne la présence de cornes et P dominant est l'allèle muté qui gouverne l'absence de cornes. Les individus issus d'un croisement entre deux parents hétérozygotes (p/P) sont repartis comme suit:
1/4 (p/p) : mâles et femelles cornus (et normalement sexués)
1/2 (p/P) : mâles et femelles sans cornes (et normalement sexués)
1/4 (P/P) : mâles sans cornes (et non intersexués), femelles sans cornes (et intersexuées)
La mutation du gène p, aujourd'hui identifiée et nommée PIS(-) (Polled Intersex Syndrome) à la place de P, a donc, selon son état, deux types de conséquences:
-à l'état hétérozygote PIS (-/+) (équivalent p/P) et homozygote PIS (-/-) (équivalent P/P), elle entraîne l'absence des cornes dans les deux sexes; c'est une mutation dominante
-à l'état homozygote, PIS(-/-) (équivalent P/P), elle entraîne, en plus de l'absence des cornes, chez des animaux de sexe chromosomique femelle XX uniquement, l'apparition d'un phénotype mâle et des ambiguités des organes génitaux externes (dans le cas d'une entière masculinisation, ces animaux sont considérés comme mâles ce qui explique le décalage de sex-ratio observé en faveur des mâles); c'est une mutation récessive qui est donc responsable d'une inversion sexuelle 'femelle vers mâle'.
Un autre effet de cette mutation est à noter chez certains mâles. Parmi les mâles stériles on trouve deux types d'individus: des animaux qui présentent des granuloma au niveau de l'épididyme avec blocage du transit des spermatozoides (mais qui peuvent être fertiles si l'atteinte est unilatérale) et qui ont une stature de mâle, et d'autres, qui présentent une hypoplasie des testicules (sont toujours stériles) et présentent une stature de femelle. Les premiers sont des mâles chez lesquelles la mutation homozygote PIS s'exprime par cette anomalie épididymaire alors que les seconds sont des femelles inversées.
D'autre part, cette mutation entraîne, chez certains animaux, un accroissement de la fertilité.
Différents phénotypes des chèvres selon le sexe chromosomique et le génotype PIS
|
Formules chromosomiques |
Génotypes |
||
|
PIS (+/+) |
PIS(+/-) |
PIS(-/-) |
|
|
XY |
Mâles cornus fertiles |
Mâles mottes fertiles plus prolifiques que les mâles PIS(+/+)
|
Mâles mottes fertiles plus prolifiques que les mâles PIS(+/+) et (+/-) Mâles mottes atteints d'obstruction de l'épididyme: -partiellement ( fertiles) -d'une manière généralisée (stériles) |
|
XX |
Femelles cornues fertiles |
Femelles mottes fertiles plus prolifiques que les femelles PIS(+/+) | Animaux mottes tous stériles, inversés sexuels -1/2 mâles XX sans ambiguité -1/2 mâles XX avec ambiguité génitales externes |
Les animaux de l'élevage de Jouy-en-Josas
La mutation polled, "sans corne", se rencontre dans différentes races, saanen et chamoisé.
Ces animaux sont les reproducteurs: animaux 'témoins' ou hétérozygotes pour la mutation PIS.
|
|
|
|
|
|
I Les observations histologiques et histochimiques
En croisant des animaux hétérozygotes PIS(-/+) entre eux, les chercheurs de l'INRA ont obtenu des inversions sexuelles chez un quart des animaux de sexe chromosomique XX.
L'examen des organes génitaux internes de ces femelles inversées sexuellement montre que les gonades qui auraient du se développer dans le sens femelle ont donné des testicules quasiment normaux.
A. Différenciation normale des gonades
Sur une durée totale de gestation d'environ 150 jours, chez les témoins des deux sexes, les crêtes génitales, ébauches de gonades indifférenciées, apparaissent à 25 jours post-coïtum (jpc).
La différenciation morphologique du testicule est visible à partir de 36 jpc sous la forme d'une édification des cordons séminifères et de l'albuginée. La production d'AMH dans les cellules de Sertoli est décelable plus précocément encore, à partir de 34 jpc, elle entraîne une régression des canaux de Müller à partir de 46 jpc. Des cellules de Leydig productrices de testostérone sont ensuite identifiables à 40 jpc. La masculinisation des organes génitaux externes commence deux jours plus tard tandis que celle des vésicules séminales et de la prostate, androgéno-dépendante, débute à 56 jpc. Enfin, la différenciation de l'épididyme et des canaux déférents débute vers 70 jpc.
La différenciation femelle commence à 36 jpc par le développement du cortex ovarien , concommitant de la multiplication des cellules germinales et de la production de l'aromatase (enzyme convertissant la testostérone en oestradiol). L'entrée en meiose des cellules germinales débute à 55 jpc tandis que la folliculogénèse commence à 90jpc.
B. Différenciation des gonades chez les femelles XX-inversées
Les femelles inversées sexuellement (PIS(-/-)) ont des gonades dont l'aspect à 36jpc ne diffère pas des témoins, mais à ce stade, l'expression de CYP19 (gène de l'aromatase) est déjà plus faible que chez les femelles témoins (PIS(+/+) ou (+/-)).
A 40jpc, les ovaires présomptifs des foetus femelles PIS(-/-) présentent déjà des différences significatives par rapport aux témoins, une réduction du cortex ovarien et un développement des cordons séminifères et de l'albuginée donnent à ces gonades le même aspect que des gonades mâles normales de 36jpc, avec des cellules de Sertoli produisant de l'AMH. De plus ces gonades inversées expriment le gène SOX9 de façon bien plus élevée que des gonades femelles.
A 56 jpc, les cellules de Leydig sont différenciées dans les gonades de femelles inversées et expriment le gène de la 3bêta-HSD (3-bêta-hydroxystéroide-deshydrogénase, une enzyme cruciale de la stéroidogénèse permettant de synthétiser de la testostérone à partir de l'androsténedione) de façon aussi élevée que dans des gonades mâles. A ce moment la gonade foetale inversée présente:
-soit un aspect de testicule identique à ceux des mâles du même satde
-soit un aspect hermaphrodite, avec des cordons spermatiques peu développés et des cellules germinales en arrêt mitotique, dans la zone médullaire, et une zone corticale renfermant des cellules germinales en prophase de meiose ou en cours de dégénérescence nucléaire.
L'expression des gènes de ces gonades est de type mâle: SOX9, AMH et 3bêta-HSD sont fortement exprimés tandis que CYP19 (aromatase) est sous-exprimé.
Ensuite, entre 56 et 70 jpc, le nombre de cellules germinales diminue très vite dans les cordons séminifères et il n'en subsiste pratiquement plus à la naissance. A ce moment, le degré de masculinisation des organes génitaux externes est variable selon les individus:
-soit de type mâle, pour les individus possédant des testicules (environ 50% des cas)
-soit ambigu: clitoris proéminent et allongement de la distance ano-génitale, pour les individus ayant des gonades hermaphrodites.
Dans tous les cas, l'absence de cellules germinales rend ces individus stériles.
Si la masculinisation extrême observée chez les foetus de chèvres XX PIS(-/-) est plus forte que celle observée chez les femelles XX inversées dans d'autres espèces comme le chien ou le porc, cela peut provenir de la précocité de cette inversion, qui n'est ici décalée que de 4 jours par rapport au décours temporel normal de la différenciation de la gonade mâle XY.
Histologie des gonades (à 56jpc), de divers types d'individus témoins ou concernés par la mutation PIS
(chaque photographie a une hauteur correspondant à 50 micromètres environ)
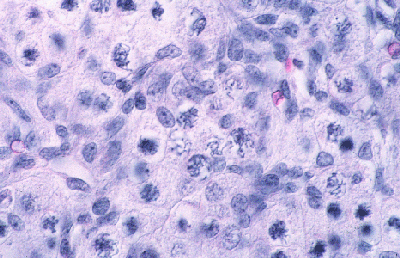
Gonade de foetus de chèvre XX, témoin non muté. |
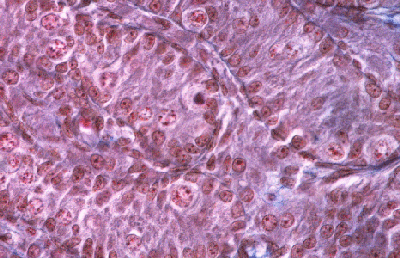
Gonade de foetus de chèvre XY, témoin non muté. |
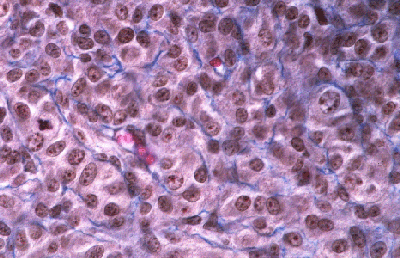
Gonade de foetus de chèvre XX, PIS (-/-), type ambigu. |
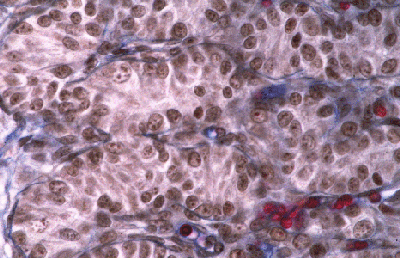
Gonade de foetus de chèvre XX, PIS (-/-), type masculinisé. |
C. L'implication du gène PIS dans la différenciation de la gonade
Le premier effet de la mutation PIS est une baisse du taux d'aromatase (dès 36 jpc). Cette enzyme qui convertit les androgènes en ostrogènes dans les cellules précurseurs des cellules folliculaires, joue un rôle prépondérant dans la différenciation femelle de nombreux vertébrés. Chez certaines espèces (tortues et oiseaux), son inhibition seule peut conduire à une inversion du sexe. Chez les femelles de ruminants, l'expression du gène de l'aromatase (CYP19) commence au début de la différenciation du sexe (au même moment que l'AMH chez le mâle) et culmine avant l'entrée en meiose des cellules germinales du cortex ovarien.
Sa sous-expression dans les gonades de femelles de chèvres XX-inversées est corrélée avec le premier signe de "déféminisation": la réduction du cortex ovarien.
II Les données génétiques
A. La mutation PIS
Le locus responsable du syndrome "absence de corne et intersexualité" est situé sur le chromosome 1 (Ch1q42). La mutation qui entraîne ce syndrome est une longue délétion de 11,7 kilobases, contenant de nombreuses séquences répétées. Cette mutation affecte l'expression d'au moins deux gènes:
-PISRT1 (PIS-regulated transcript1) qui code pour un ARNm de 1.5 kb dépourvu de cadre de lecture (non traduit en protéine)
-FOXL2 qui est responsable du syndrome BPES chez l'homme (Blepharophimosis Ptosis Epicanthus inversus Syndrome)
Ces deux gènes sont respectivement localisés à 20 et 200 kb de la déletion (en direction du télomère)
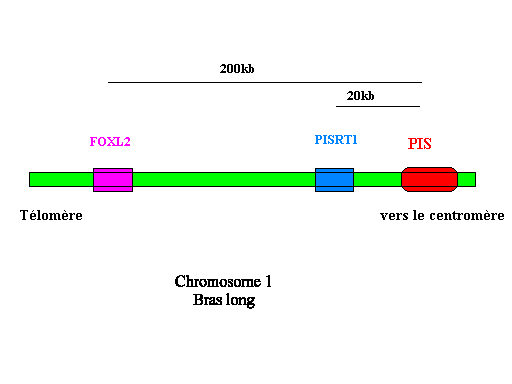
La région humaine, homologue du locus PIS, a été localisée sur le chromosome 3 (Ch3q23). Des mutations invalidant le facteur de transcription FOXL2 ont pour conséquences médicale le syndrome BPES, qui conduit à une malformation des paupières associée à une stérilité féminine par déficience ovarienne primaire.
Plusieurs expériences montrent que la mutation PIS exerce une régulation à distance de la transcription de PISRT1 et de FOXL2.
B. Les effets de la mutation PIS
L'expression de PISRT1 est sexuellement dimorphique; dans les gonades foetales, à partir de 36 jpc, son expression est plus élevée chez les femelles témoins que les mâles témoins. Dans les gonades de foetus femelles inversés (PIS-/-), son niveau d'expression est d 'abord de type ovarienne (élevée), à 36jpc, et baisse ensuite, dès 40jpc, adoptant un niveau de type testiculaire.
Pour FOXL2, la transcription est également sexuellement dimorphique; là aussi, elle est plus élevée dans la gonade femelle normale que la gonade mâle normale. Chez les femelles sexuellement inversées, les gonades foetales présentent un taux d'expression de FOXL2 extrêmement bas dès 36 jpc.
La délétion PIS affecte donc l'expression des gènes PISRT1 et FOXL2 dans les gonades. Elle renferme donc une région régulatrice.
Chez l'homme, FOXL2 est un gène dont l'expression peut être modifiée par une translocation située 100 kb en amont , il existe donc également chez l'homme une région régulatrice de ce gène, qui reste encore à découvrir.
Chez la chèvre, l'étude des profils d'expression des gènes PISRT1 et FOXL2 a été mise en parallèle avec celle de SOX9. A 36 jpc, ches les XX-inversés, l'expression de PISRT1 est toujours élevée, comme chez les femelles, et celle de FOXL2 est déjà effondrée. A 40 jpc, celle de PISRT1 s'effondre à son tour. C'est au cours de l'effondrement de l'expression de PISRT1 que celle de SOX9 commence à s'élèver dans les gonades de femelles inversées, adoptant un niveau similaire à une gonade mâle. C'est sur cette constatation que repose l'hypothèse que FOXL2 est un gène "ovarien" , un ODF (Ovarian Determing Factor), et PISRT1 un gène de contrôle "mâle", de type antitestis, empêchant normalement la différenciation mâle chez une femelle XX (voir le C. Corrélation avec le modèle du gène Z).
Profils d'expression de divers gènes impliqués dans la différenciation de la gonade en ovaire ou testicule,
chez des animaux témoins et des XX PIS(-/-) indiqués par leur numéro (250, 252...)
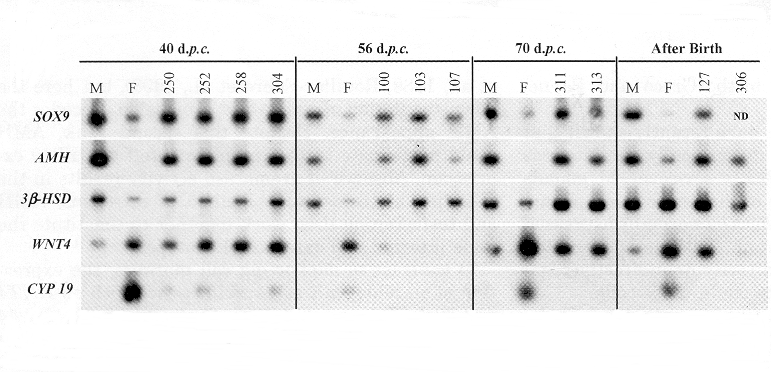 |
| Ces RT-PCR (Reverse Transcriptase-Polymerase Chain recation), réalisées sur des gonades prélevées à différents moments du développement, montrent que les gonades inversés sexuellement (numéros) expriment les gènes SOX9 et AMH caractéristiques des gonades mâles (M) et n'expriment pas le gène CYP19 (de l'aromatase) caractéristique des gonades femelles (F). En ce qui concerne le gène de la deshydrogénase (3bêta-HSD) impliquée dans la synthèse des stéroides, les gonades inversées l'expriment plus tôt que les gonades femelles, adoptant ainsi un profil d'expression de type mâle. |
Une sur-expression de gènes mâles comme SOX9 (gène très conservé au cours de l'évolution) a été observée du 36ème au 40ème jpc chez les XX-inversés au lieu de 32 à 35 chez les mâles normaux. Le gène SOX9 qui intervient très tot dans la différenciation mâle de la gonade, est capable d'induire l'expression de l'AMH dans les cellules de Sertoli. Après la sur-expression de SOX9 on observe chez les foetus XX-(PIS-/-) une surexpresion de l'AMH à partir de 40 jpc, entrainant une régression des canaux de Müller et une inhibition secondaire de l'expression de l'aromatase (postérieure cette fois à la baisse de l'expression observée précocément).
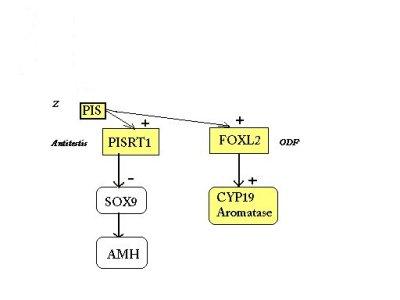
C. Corrélation avec le modèle du gène Z
Depuis 1993, Mc Elreavey et ses collaborateurs ont postulé l'existence d'un gène (nommé Z à l'époque) dont le rôle serait d'orienter la différenciation de la gonade dans le sens femelle en inactivant un gène de détermination du sexe mâle.
L'inactivation de ce gène Z, serait donc de mise chez tous les mâles normaux et apparaitrait de façon inoppinée chez certaines femelles par mutation de ce gène, entrainant alors, même en absence de SRY - et c'est là que se trouve l'intérêt de ce modèle - une différenciation de la gonade en testicule et une inversion sexuelle.
Les observations réalisées dans le cas des chèvres mottes sont cohérentes avec un modèle dans lequel PISRT1 inhibe SOX9, jouant le rôle d'un gène antitestis, comme proposé dans le modèle du gène Z
Le gène FOXL2 est impliqué dans le maintien des ovaires, peut-être par son action précoce sur la folliculogénèse, et pourrait constituer un ODF.
La proximité de ces deux gènes du même élément régulateur autorise une régulation concommitante de ces deux gènes, par la séquence régulatrice PIS, qui serait l'équivalent de Z.
Ainsi, selon cette hypothèse, cette région du chromosome 1 contient un élément régulateur, un antitestis et un gène de détermination ovarienne. Chez la femelle l'élément régulateur PIS (gène Z) inhibe le sexe mâle par l'activation d'un antitestis et stimulation d'un ODF. Chez le mâle cette région régulatrice PIS doit être inhibée et c'est le gène SRY qui, potentiellement, est le meilleur candidat à cette fonction.
SCHEMA BILAN de l'hypothèse actuelle de l'implication de PISRT1 et FOXL2 dans le déterminisme du sexe
(les gènes qui s'expriment sont en couleur)
 |
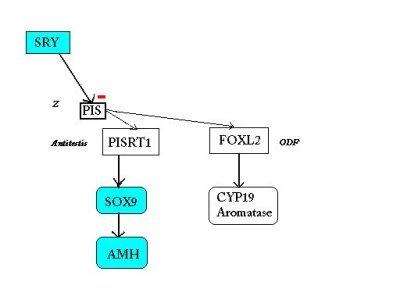 |
| Chez la femelle: la région régulatrice PIS entraîne - l'expression de PISRT1 qui, par son ARNm, inhibe SOX9 et la cascade de type mâle, - et l'expression de FOXL2 qui déclenche à son tour celle de CYP19 et la synthèse de l'aromatase( responsable de la production d'oestrogènes). |
Chez le mâle: SRY inhibe la région régulatrice PIS (hypothétique gène Z, orientant la détermination vers le sexe femelle).
Ainsi PISRT1 n'est pas lu et SOX9 n'est donc pas inhibé, il s'exprime et déclenche la cascade mâle tandis que l'absence d'expression de FOXL2 empêche la production d'aromatase. |
Comment expliquer la variabilité des phénotypes observés chez les individus de génotype PIS(-/-)?
Dans de nombreux cas d'intersexualité , on rencontre, pour des génotypes similaires, des phénotypes variés. Le processus de détermination du sexe met en jeu de nombreux gènes, intervenant par un subtil dosage de leur expression, comme WT1, SF1, SOX9 ou encore DAX1. Les plus petites modifications de ce dosage peuvent affecter la différenciation de la gonade et être à l'origine d'une masculinisation plus ou moins prononcée.
Pourquoi les cellules germinales dégénèrent-elles dans les gonades des individus XX PIS(-/-) inversés sexuellement ?
La dégénérescence des cellules germinales de la gonade XX PIS(-/-) ne se réalise pas à un moment précis mais débute dès 56jpc (moment où ces cellules devraient entrer en méiose chez une femelle XX) et continue jusqu'à la naissance. Deux explications peuvent être avancées.
- D'une part, cette dégénérescence peut provenir d'une anomalie du dosage des gènes portés par X. En effet, les cellules germinales XX subissent une inactivation de l'un de leur chromosome X au cours de leur migration, à partir de l'allantoide, et réactivent le X inativé lorsqu'elles atteignent la crête génitale du mésonéphros. Dans une gonade XX-PIS(-/-), se différenciant en testicule, ces cellules n'entrent pas en meiose, et réactivent le X inactivé au même moment que dans une gonade XX. Il est possible que l'expression de deux chromosomes X soit incompatible avec le développement de cellules germinales de type mâle.
- D'autre part, il a été montré que la présence d'AMH dans une gonade XX au moment où les cellules germinales devraient entrer en méiose est responsable de leur dégénérescence (voir la synthèse sur le free-martin). Ici la mutation PIS(-/-) entraine une expression de SOX9 et donc une production d'AMH par les cellules précurseurs de sertoli qui se différencient dans les cordons séminifères de cette gonade inversée.
IV De la chèvre à l'homme
Chez l'humain, 90% des cas d'intersexualité de type "XX-mâle" concernent des individus ayant deux chromosomes X mais dont l'un porte un fragment du chromososme Y contenant le gène SRY. Les 10% de cas d'intersexualité restant ne sont pas dus à SRY, tout comme les chèvres porteuses de la mutation PIS.
Ces cas humains sont inexpliqués d'où l'intérêt du modèle caprin pour tenter d'en comprendre le déterminisme génétique.
Ce modèle caprin pourrait avoir un autre intérêt en génétique humaine. Le phénotype particulier (absence de cornes et intersexualité) décrit chez les chèvres a pour origine une anomalie localisée dans une rgion du génome caprin possédant un homologue dans le génome humain. Cette région du génome humain est impliquée dans une maladie rare, le Blepharophymosis-Ptosis-Epicanthus inversus Syndrome (BPES). Ce dernier associe, chez les femmes, une malformation des paupières et une stérilité ou une ménopause précoce (anomalie ovarienne: présence de très peu de follicules). Dans cette maladie humaine, c'est le fonctionnement du gène FOXL2 qui est perturbé. Le plus souvent il s'agit de mutations "classiques" du gène, mais dans certains cas, non encore élucidés, c'est une perturbation "à distance" du gène FOXL2 qui se produit, rappelant ainsi le mécanisme observé chez les chèvres (une séquence régulatrice, homologue de celle décrite chez la chèvre, reste encore à découvrir dans cette région du génome humain).
Et maintenant....
Les recherches qui sont menées à l'INRA de Jouy tendent à valider le modèle précédent.
Pour ce faire deux biotechnologies dont l'INRA a le secret ont été réalisées:
•un clonage: le noyau d'une cellule de chèvre XX-PIS(-/-) a été transféré dans un ovocyte de chèvre normale (clonage somatique à partir de fibroblastes d'un foetus XX PIS(-/-), obtenu par croisement classique entre un bouc et une chèvre hétérozygotes PIS(-/+)). Le blastocyste qui en a résulté a été implanté dans l'utérus d'une mère porteuse et a donné un chevreau XX-intersexué. Cette expérience a servi de preuve de faisabilité technique et montre que l'intersexualité observée est entièrement sous contrôle génétique.
•une transgénèse: la technique précédente a été reprise avec pour seule modification l'introduction par transgénèse du fragment d'ADN contenant le gène PISRT1 et son promoteur dans le noyau initialement transféré. Ce gène devrait rétablir l'effet dû à la délétion de la région PIS , c'est à dire inhiber l'expression de SOX9 et entraîner la différenciation des chevreaux dans le sens femelle....résultats en attente!