Logiciel Cytométrie et ressources pédagogiques
Le logiciel Cytométrie peut être utilisé pour introduire l'étude des cellules du système immunitaire, en complément de la microscopie.
Utilisation du logiciel Cytométrie.
Par ailleurs, les données de cytométrie en flux exploitées par ce logiciel permettent de suivre les modifications du système immunitaire en réponse à une infection et de familiariser les élèves avec quelques marqueurs de surface (CD).
- Découvrez le logiciel avec l'exemple du suivi du système immunitaire chez des patients atteints du SIDA
- Trouvez une présentation de la technique de cytométrie en flux
Ressources pour le nouveau programme de TS (2012) :
- Utilisation du logiciel pour la reconnaissance et la numération des leucocytes sanguins
- Utilisation du logiciel pour illustrer la dynamique de la réponse adaptative en réponse à l'infection par le virus de la grippe.
- Les données de cytométrie peuvent concerner d'autres domaines que l'immunologie, par exemple le suivi de la réplication de l'ADN.
Découverte du logiciel sur l'exemple du suivi du système immunitaire chez des patients atteints du SIDA
Plan :
1 - Chargement de données provenant de trois individus
2 - Interprétation des données morphologiques concernant les cellules
3 - Utilisation des données de fluorescence
4 - Comparaison avec des données pathologiques
-
Chargement de données provenant de trois individus
Utiliser le menu Fichier/Ouvrir et choisir le fichier SuiviSida.fcs.
Le fichier se charge et le graphique par défaut s'ouvre automatiquement. Ce graphique correspond à la première série de données (concernant un individu sain). Il représente la taille des cellules en fonction de leur granularité (qui correspond plus ou moins à leur complexité). Chaque point représente une ou plusieurs cellules ayant les mêmes caractéristiques suivant ces deux paramètres.
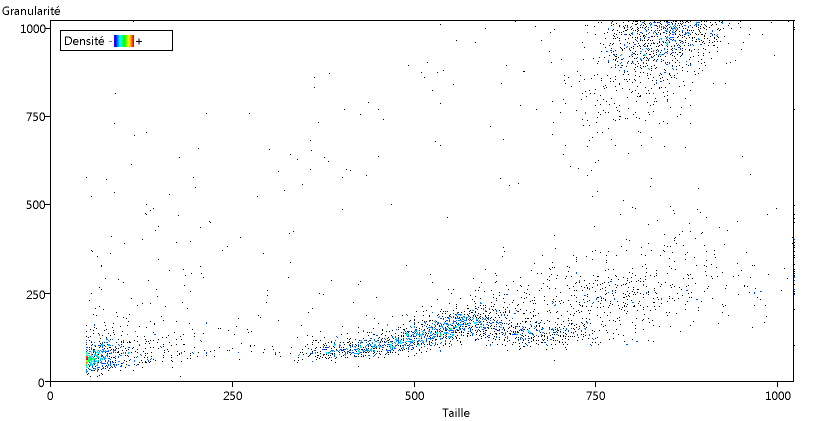
A ce stade, les couleurs correspondent aux densités : plus le nombre de cellules correspondant à un point (densité) est grand plus la couleur est proche du rouge.
L'échantillon analysé correspond à une fraction des leucocytes. Une bonne partie des granulocytes a été éliminée, il reste aussi sans doute une petite partie des hématies.
Sur le graphique on peut repérer plusieurs groupes de cellules que l'on peut interpréter à partir des observations microscopiques.
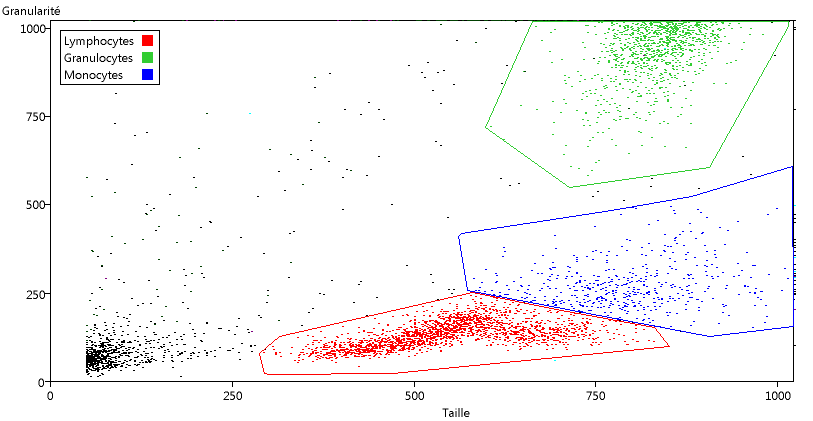
En bas à gauche se trouvent les débris cellulaires et les hématies qui n'ont pas été éliminées. Ensuite viennent des petites cellules non granuleuses, que l'on peut identifier aux lymphocytes, puis des cellules plus grosses et un peu plus granuleuses (les monocytes) et enfin vers le haut à droite de grosses cellules granuleuses qui doivent correspondre aux granulocytes.
Pour délimiter ces groupes sur le graphique, utiliser le menu Catégorie/Délimiter sur le graphique (dans la fenêtre du graphique).
Cliquer sur les angles du polygone de délimitation. Terminer en cliquant avec le bouton droit de la souris. Le polygone est alors fermé et le nom de la catégorie est demandé. Dès que l'on a délimité une catégorie, l'affichage des couleurs correspond aux catégories délimitées et on obtient le graphique suivant :
 Si on veut déplacer la légende, il suffit de double-cliquer dessus puis de la déplacer avec la souris.
Si on veut déplacer la légende, il suffit de double-cliquer dessus puis de la déplacer avec la souris.
Si on souhaite ajouter un titre, il faut utiliser le menu Edition/Choisir le titre.
Le menu Edition/Copier permet de copier le graphique pour l'insérer par exemple dans un traitement de texte pour faire un compte-rendu.
Le menu Fichier/Imprimer donne la possibilité d'imprimer le graphique en un ou plusieurs exemplaires sur la même page.
Haut de page
Les catégories délimitées sur ce graphique ne sont pas assez précises. On peut aller plus loin en utilisant les données de fluorescence. Celles-ci sont généralement obtenues à l'aide d'anticorps spécifiques d'un marqueur caractéristique d'un type cellulaire. Pour être facilement mis en évidence, ces anticorps sont artificiellement associés à un fluorochrome dont la fluorescence est obtenue à l'aide d'un des faisceaux laser du cytomètre.

La quantité de lumière émise par les fluorochromes associés aux anticorps donne une mesure de la quantité de molécule-cible présente à la surface des cellules. En immunologie, ces molécules-cibles sont souvent des marqueurs CD qui sont caractéristiques d'un type cellulaire.
Commençons par utiliser la fluorescence associée au marqueur CD3, caractéristique des lymphocytes T.
En revenant à la fenêtre principale du logiciel, utiliser le menu Graphique/Nouveau. Dans la nouvelle fenêtre, choisir la même série de données qu'au départ (Cas normal), puis CD3 comme paramètre 1 et (Histogramme) comme paramètre 2 (donc pas de paramètre 2).
L'histogramme du nombre de cellules en fonction de leur quantité de CD3 est tracé. Remarquer l'échelle logarithmique en abscisse : les valeurs de fluorescence varient considérablement d'une cellule à l'autre. Le premier pic, correspond presque toujours aux cellules qui ne possèdent pas le marqueur. La valeur atteinte sur l'échelle de fluorescence dépend essentiellement des réglages du cytomètre. Il est donc important de ne comparer que des données formant un ensemble et où les réglages sont analogues. Sur le site, ces données sont groupées dans un même fichier, comme celui de cet exemple.
Sur ce nouveau graphique, demander de délimiter une catégorie (menu Catégories/Délimiter...).
Enfoncer le bouton de la souris vers le niveau 100 de CD3 et ne relâcher le bouton qu'une fois que l'on a déplacé le maximum de l'axe horizontal.
Nommer la catégorie CD3+ et cliquer sur la couleur proposée pour la remplacer par une teinte qui tranche plus avec celle choisie pour les lymphocytes. Cliquer sur OK.
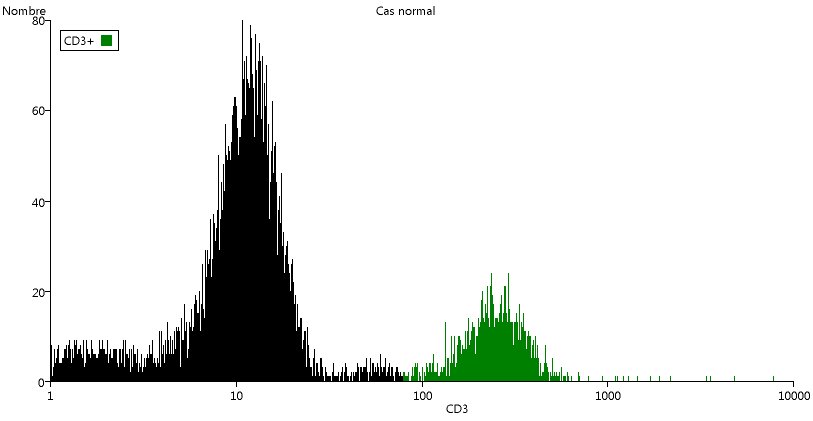 La couleur est appliquée sur la zone correspondante de l'histogramme, et sur le graphique 1, beaucoup de points, au ni veau des lymphocytes sont colorés en vert sombre (si c'est la couleur choisie). Ce sont les lymphocytes T.
La couleur est appliquée sur la zone correspondante de l'histogramme, et sur le graphique 1, beaucoup de points, au ni veau des lymphocytes sont colorés en vert sombre (si c'est la couleur choisie). Ce sont les lymphocytes T.
De la même manière on peut mettre en évidence les cellules CD4+ ou CD8+.
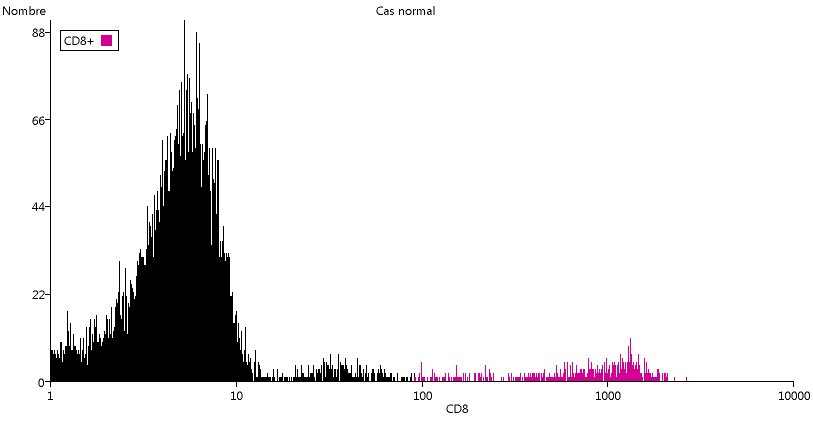
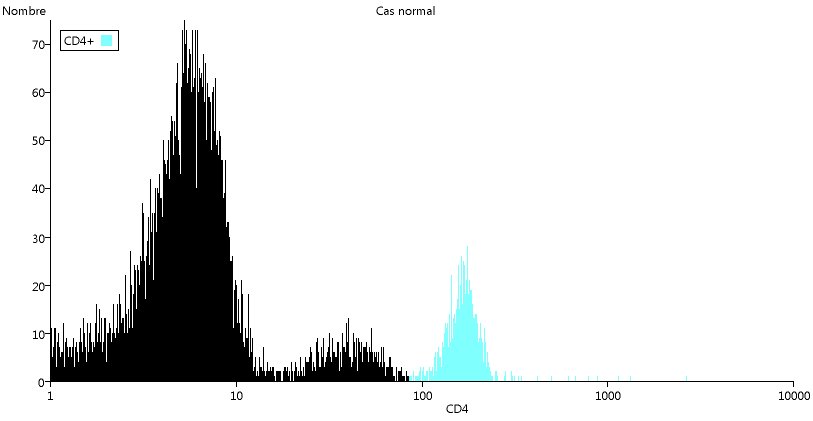
Dans les deux cas, on peut se demander s'il faut se limiter au dernier pic ou prendre les deux derniers pics. Dans le cas du CD4, le deuxième pic correspond aux monocytes et donc pas aux LTCD4+.
Sur le graphique Taille - Granularité, cela donne :
La couleur correspondant au CD3 ne s'observe plus : Elle est masquée par celle des CD8 ou des CD4. Les points qui restent en rouge sont sont les lymphocytes B.
Une autre représentation intéressante est obtenue si on choisit CD4 pour l'abscisse et CD8 pour l'ordonnée :
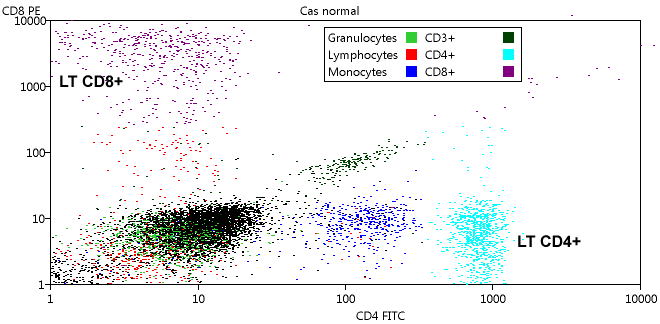 La légende a été déplacée pour ne pas masquer les LT CD8+.
La légende a été déplacée pour ne pas masquer les LT CD8+.
Haut de page
Demander un nouveau graphique, et cette fois choisir les données Cas grave. Il s'agit de l'analyse d'un échantillon comparable au premier étudié, mais provenant d'un malade du SIDA.
Comme les paramètres sont les mêmes, les catégories définies dans le cas normal sont conservées. Le graphique qui s'affiche est coloré en fonction des catégories.
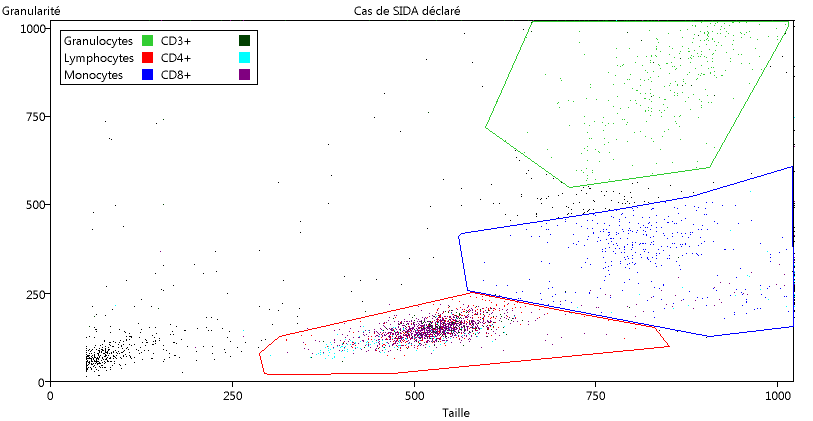 On constate la forte diminution des LT CD4+.
On constate la forte diminution des LT CD4+.
Cette diminution s'observe aussi sur l'histogramme :
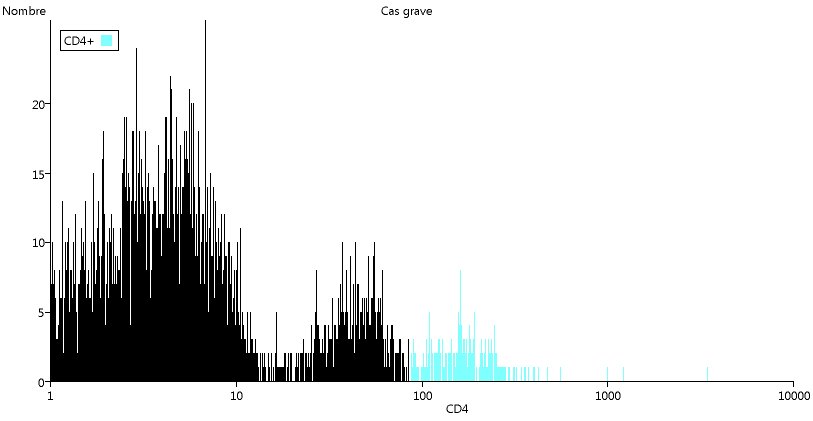
Ici encore, on peut utiliser les possibilités de copie et d'impression.
Haut de page
