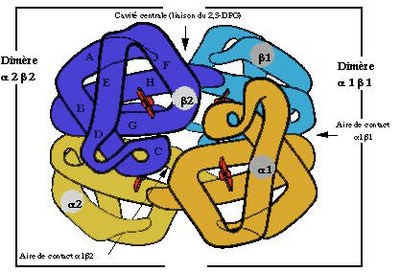
hémoglobine : structure et fonction
L'hémoglobine transporte le dioxygène
L'hémoglobine rend compte de 33% du poids des globules rouges. Elle est à l'origine du pouvoir oxyphorique du sang.
Chez l'homme, où le taux normal d'hémoglobine de 14 à 15 g/dl, la capacité de transport d'un décilitre de sang est d'environ 20 ml d'oxygène. Ce même volume de plasma ne peut transporter sous forme dissoute que 0,5 ml d'oxygène.
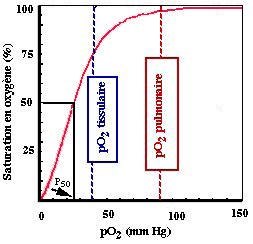
L'hémoglobine se charge en oxygène dans les poumons et le libère dans les organes selon une courbe sigmoïde qui témoigne d'une interaction entre ses sous-unités. Lorsque la pression partielle en oxygène (ou pO2 ) chute de 100mm de Hg (dans les artères) à 40 mm de Hg (dans les capillaires veineux), un décilitre de sang libère entre 4 à 5 ml d'oxygène. Ceci correspond à la fraction d'oxygène physiologiquement utilisable.
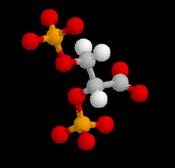
Dans le globule rouge humain, un organophosphate, le 2,3 diphosphoglycérate joue un rôle régulateur physiologique fondamental dans le transport de l'oxygène. Il se lie à la molécule d'hémoglobine désoxygénée. En stabilisant cette conformation il facilite la libération d'oxygène dans les tissus.
famille multigénique
Les hémoglobines forment une famille très ancienne de molécules, apparue simultanément à la vie aérobie dans l'évolution des espèces.
Il y a quelques 400 millions d'années, la duplication d'un gène ancestral codant pour une hémoprotéine transporteuse d'oxygène a donné naissance à deux familles de molécules. La première est celle des myoglobines: elles sont formées d'une seule sous-unité et servent à stocker l'oxygène dans les organes (principalement les muscles) à proximité de son lieu de consommation. La seconde est celle des hémoglobines, protéines multimériques, spécialisées dans le transport d'oxygène de la périphérie vers les tissus.
Chez tous les vertébrés, l'hémoglobine est un tétramère dont les sous-unités sont identiques deux à deux et se distinguent en type alpha et béta.