Cycle cellulaire : Réplication de l'ADN
Réplication de l'ADN
Jean François Héron, Faculté de médecine,
Centre François Baclesse 14021 Caen
jfheron@baclesse.fr
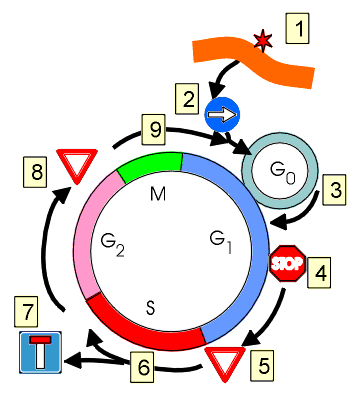
Les phases du cycle cellulaire
On appelle cycle cellulaire l’intervalle entre chaque division cellulaire
Chaque cycle cellulaire consiste dans 4 phases successives :
- phase G1 (pour Gap ou Growth phase 1)
- phase S (DNA synthesis)
- phase G2 (pour Gap ou Growth phase 2)
- phase M (pour mitose ou méiose)
On appelle G0 l’état de repos des cellules qui ne se divisent pas.
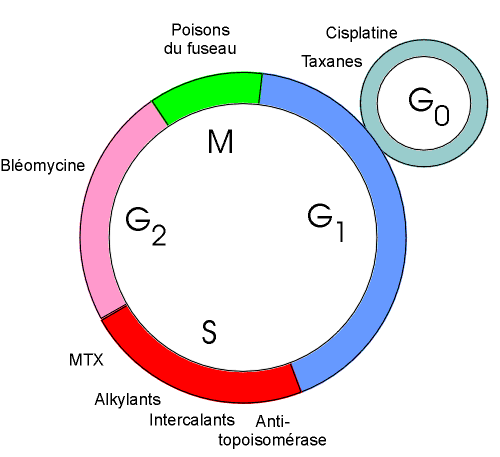 |
| Représentation schématique du cycle cellulaire. |
Les points de contrôle
Entre ces différentes étapes, se situent des points de contrôle ou ‘check-point’, qui ont pour but de vérifier l’intégrité de la transmission du DNA de la cellule mère vers les cellules filles.
Les principaux points de contrôle décrits sont :
- Un point de contrôle entre les phases G1 et S, qui autorise ou non la poursuite de la duplication du DNA et dont le régulateur majeur est la protéine p53.
- Un point de contrôle entre les phases G2 et M, qui autorise la division cellulaire, mais dont on connaît moins bien les protéines régulatrices.
Chacune des étapes du cycle cellulaire est sous la dépendance de mécanismes régulateurs avec des rétro contrôles (ou feed back), en rapport avec des protéines ou des glycoprotéines dont l’existence, la structure et le rôle sont toujours en train d’être découverts ou mieux définis.
Il existe, en outre, des mécanismes de régulation positifs et négatifs en rapport avec la situation de la cellule normale (multiplication réactionnelle, cicatrisation, contrôle de l’homéostasie, etc.). Ces mécanismes ne sont pas tous connus et impliquent les voies de transmission du signal entre le milieu extra-cellulaire, la membrane cellulaire, le cytoplasme et les molécules du noyau.
|
|
|
Le contrôle du cycle cellulaire. [1] Sous l’influence de facteurs de croissance, la cellule reçoit le signal de se diviser. [2] Transmission du signal. [3) Les cellules sortent de G0 et progressent au delà d’un point de restriction [4] si elles reçoivent à un stimulus constant. [5] Il existe un point de contrôle ne laissant se diviser que le DNA normal. [6] La cellule double sa quantité de DNA. En cas d’anomalie non réparable du DNA, elle évolue vers la mort [7] (apoptose). [8] Il existe un nouveau point de contrôle avant la séparation du matériel génétique vers deux cellules filles. [9] La mitose s’accomplit. Les cellules filles se séparent et retournent en G0, sauf si un stimulus entretient le processus de division. |
La synthèse de DNA ou phase S
Le détail de la synthèse du DNA sera détaillé dans le paragraphe suivant.
La durée de cette phase est variable, de quelques minutes pour les cellules embryonnaires à plusieurs heures pour la plupart des cellules somatiques. Pour celles-ci, en effet, pendant cette phase, la cellule continue à transcrire activement les gènes des protéines nécessaires à leur survie et au maintien des fonctions spécialisées.
Pendant la phase S, la cellule dédouble aussi le centrosome, nécessaire à la migration des chromosomes. Les deux centrosomes migrent autour du noyau et se positionnent de façon diamétralement opposée.
La phase M
La phase M, ou mitose, est la période de division cellulaire : les chromosomes, le matériel nucléaire et cytoplasmique sont divisés entre les deux cellules filles. Le contenu en DNA passe ainsi de 4N à 2N. Au cours de cette phase, le rôle des microtubules du fuseau est particulièrement important. La durée de la phase M est en général très courte, inférieure à une heure.
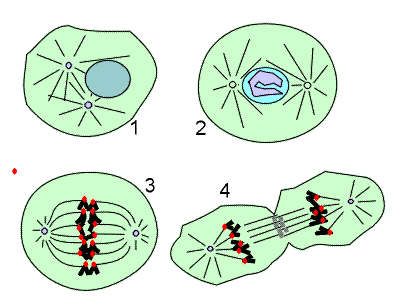
Description histologique de la phase M
La phase M s'observe facilement au microscope, avec la condensation des chromosomes (prophase) dans le noyau encore intact. Puis survient la séparation des deux centrosomes qui se placent aux deux pôles (ou asters) d'un faisceau de microtubules et de protéines, le fuseau mitotique. Puis les microtubules astériens se désagrègent et de nouveaux microtubules s'assemblent en se dirigeant vers les chromosomes très condensés. L'enveloppe nucléaire se disperse. Les chromosomes s'alignent au milieu du fuseau, pour former la plaque métaphasique (métaphase).
|
|
|
Les différentes étapes de la mitose. [1] et [2] Prophase : condensation des chromosomes et séparation des centrosomes. [3] Les chromatides se séparent et migrent fers les pôles du fuseau. [4] La division cellulaire est accomplie (télophase). |
Les deux chromatides se séparent et migrent vers les pôles du fuseau, par l'intermédiaire des kinétochores (Anaphase A). Les deux pôles du fuseau s'éloignent l'un de l'autre (Anaphase B).
Les deux cellules filles se séparent, les chromosomes disparaissent pour laisser place à une chromatine fine diffuse, l'enveloppe nucléaire se reforme, puis la membrane cytoplasmique, et un nouveau réseau de microtubules apparaît dans le cytoplasme (Télophase).
Rôle des microfilaments
Les microtubules sont des tubes creux composés de protofilaments (en général 13) formés par l'assemblage d'hétérodimères de chaînes a et b de tubuline.
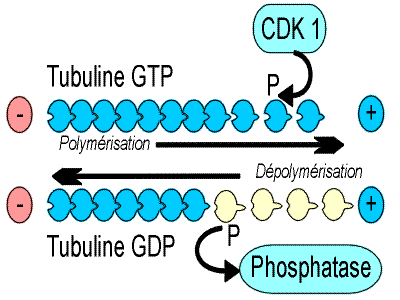 |
| Rôle des phosphatases et des kinases pour le développement harmonieux des microtubules. Les kinases apportent de l’énergie qui permet la polymérisation de la tubuline en présence de GTP, les phosphatases dépolymérisent la tubuline. Il s’agit en fait d’un équilibre dynamique permanent. |
Ce dimère possède à ses extrémités des sites de liaison avec le GTP asymétriques, et on distingue ainsi une extrémité positive (+) et une extrémité négative (-), alors que le corps de la tubuline est de type GDP.
La molécule de tubuline est, par nature, instable (instabilité dynamique) : en présence de protéine kinase, sa taille s’accroît (polymérisation GTP dépendante) ; en présence de phosphatase, elle décroît (dépolymérisation par phosphorylation). La phosphokinase cdk1 est l'agent qui apporte le phosphate.
Pendant l'interphase, une des fonctions du microtubule est le transport des vésicules cytoplasmiques par des 'moteurs protéiques' se déplaçant le long des microtubules soit vers l'extrémité positive (kinésines) soit vers l'extrémité négative (dinéines).
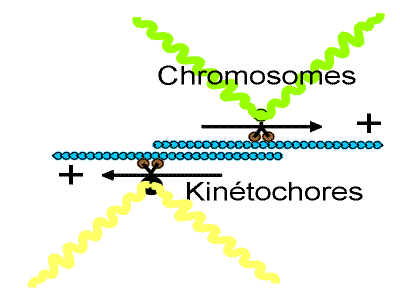 |
Rôle des kinétochores pour la mobilité des chromosomes.
Pendant la mitose, les microtubules des deux demi fuseaux ont une polarité inversée. Les deux asters sont le siège d'une nucléation (ou polymérisation intense). Certains tubules entrent en contact avec les kinétochores des chromosomes. Le chromosome migre rapidement le long du microtubule vers le centrosome puis s'en éloigne, trouvant une position d'équilibre au niveau de la plaque métaphasique. Lorsque les chromatides se séparent, les kinétochores agissent comme des kinésines et transportent les chromatides vers le pôle positif. On retrouve au niveau de ces kinétochores un moteur protéique régulée par une phosphatase de type 1.
On verra, plus loin, que certains médicaments anticancéreux agissent sélectivement au niveau de la tubuline (perte de l'instabilité dynamique) et du fuseau.
Phase G2
C'est la phase séparant la synthèse d'une copie du DNA nucléaire de la séparation physique des deux cellules.
Sa durée est extrêmement nstante et le plus souvent courte (quelques heures au maximum). Il s'agit d'une phase automatique : les cellules entrées dans la phase S aboutissent toujours à la phase M. C'est une phase de contrôle de la bonne transcription du matériel génétique, impliquant des gènes et des protéines importants pour le bon déroulement de la mitose.
Phase G1
C'est la phase du cycle cellulaire dont la durée est la plus longue et la plus variable selon le type cellulaire. Le temps passé en G1 est inversement proportionnel au taux de prolifération. Lorsque les conditions extérieures ne sont pas favorables à la prolifération, les cellules s'arrêtent en G1 : les cellules déjà impliquées dans une division (phase S, G2 ou M) la complètent pour arriver en phase G1.
Pendant cette phase, la cellule croît en taille, et fabrique les protéines cytoplasmiques qui seront ensuite divisées pour les cellules filles.
Phase G0
On appelle ainsi une période, plus ou moins longue, pendant laquelle la cellule est dans un état de repos, non prolifératif. Ces cellules contiennent un matériel nucléaire 2N, et ressemblent, au microscope, aux cellules en G1. Cependant, elles n'ont pas le même métabolisme protéique ou du RNA.
Certaines cellules terminales sont dans un état G0 définitif, comme les polynucléaires ou les neurones. D'autres peuvent, sous l'effet de facteurs externes, passer de l’état de repos G0 à l’état actif G1 (ainsi les hépatocytes après hépatectomie partielle, ou les lymphocytes avant la stimulation antigénique
L'organisation du génome :
La molécule de DNA
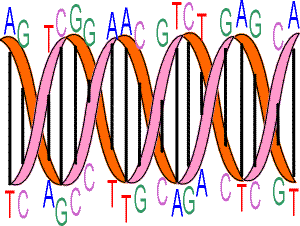
L'information génétique est stockée dans les deux chaînes de DNA, longs polymères non branchés de nucléotides, constitués d'un sucre (le déoxyribose), un groupe phosphate et une base purique ou pyrimidique. Les règles de Watson et Crick montrent que les deux chaînes sont complémentaires : des couples de bases Adénine et Thymine ainsi que Guanine et Cytosine sont constitués sous l'effet de ponts hydrogènes entre les bases.
Représentation très schématique de l’hélice du DNA
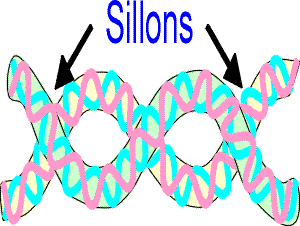
Voir une molécule d'ADN en 3DReprésentation schématique de la structure secondaire du DNA, et de la formation des sillons, où viendront agir préférentiellement les facteurs de transcription (cf. plus loin).
La double hélice est une molécule relativement rigide. Dans sa forme B, les arêtes créées par les groupements phosphates définissent deux sillons : le petit et le grand sillon, seul endroit où les bases sont accessibles aux protéines.
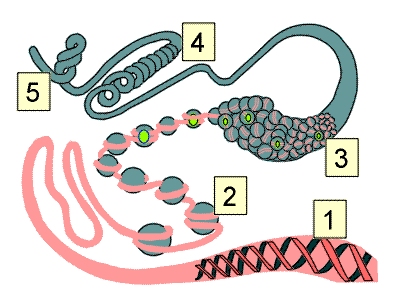 |
| Représentation très schématique de la succession d’enroulements qui caractérisent la molécule de DNA au niveau des chromosomes : [1] La double hélice classique : il y a environ 10 paires de base par tour. [2] L'hélice s’enroule autour des histones, molécules chargées positivement pour former un nucléosome : il y a environ 200 bases par nucléosome. Attention : l'image 3D est superbe mais elle fait 378Ko. [3] Les nucléosomes se regroupent en s’enroulant sous forme de fibres de 30 nm. [4] Chacune de ces fibres s’enroulent sous forme de spirale comportant environ 50 fibres. [5] Les spirales se regroupent sous forme de mini-bandes visibles en microscopie optique et qui comportent environ 18 spirales ou plus d’un million de paires de base. Chaque chromosome comporte environ un million de mini-bandes. |
La double hélice se complique, en certains endroits, d'un enroulement supplémentaire dit superenroulement (forme Z), ainsi que d'un enroulement autour des histones (formation de nucléosomes) et d'autres protéines nucléaires.
Le software basique de la génétique : le réarrangement des bases
La capacité des molécules de DNA à stocker l'information génétique réside dans l'arrangement des séquences de bases le long du polymère sous forme de codons de trois bases. Les informations utiles pour la synthèse des protéines se trouvent sous forme de gènes séparés les uns des autres par des suites immenses de nucléotides, sans signification fonctionnelle apparente.
Ces zones présentent cependant l'intérêt d'être constantes pour un même individu, et de permettre une véritable identification moléculaire ('empreintes du DNA'), certaines séquences répétitives étant faciles à repérer. La plupart des mutations surviennent dans ces zones silencieuses non géniques.
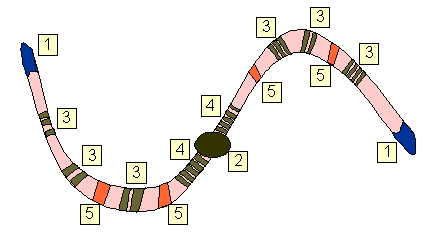 |
| Représentation schématique des différentes zones composant un chromosome : [1] Aux deux extrémités du chromosome, les télomères ; [2] Le centromère ; [3] Les séquences non codantes modérément répétitives; [4] Les zones très répétitives (zones Alu de 300 BP), ne correspondant pas à un gène ; [5] Les gènes, plus ou moins spécifiques, certains gènes (comme ceux codant pour le RNA ribosomal ou le RNA messager étant codés des centaines de fois). |
La réplication semi-conservative du DNA
Lors de la division cellulaire, les deux chaînes de DNA sont séparées à une extrémité. La lecture du code génétique se fait de l'extrémité 3' vers l'extrémité 5', par appariement des bases selon la loi de Watson et Crick. La molécule fille croît donc de l'extrémité 5' vers l'extrémité 3'.
Les deux molécules filles qui en résultent comportent une chaîne parentale et une chaîne dérivée (d'où le nom de duplication semi-conservative). Chaque brin de deux chaînes est formé à partir de la fourche de séparation, par une lecture immédiate de la base à compléter.
La synthèse de DNA est semi discontinue, et nécessite un segment d’initiation à base de RNA ou primase. Un des brins du DNA, celui ayant l’extrémité 5’ constitue le brin leader : sa copie se fait directement par l’intermédiaire de la DNA polymérase d. L’autre brin nécessite la synthèse de petits fragments (fragments de Okazaki), en sens inverse du brin leader (de 5’ vers 3’) grâce à la même DNA polymérase d. Ces fragments sont ensuite rassemblés par une DNA polymérase I et par une DNA ligase.
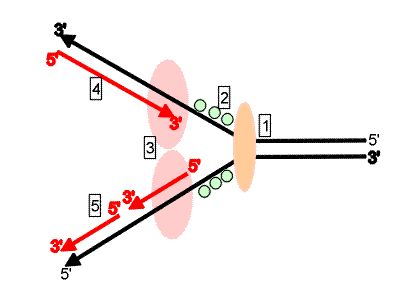 |
| Schéma de la fourche de réplication. [1] L’hélicase sépare les deux brins du DNA. [2] Les protéines de liaison empêchent les deux brins de se recoller. [3] Les polymérases synthétisent les nouveaux bras de 5’ en 3’. [4] Le brin direct est retranscrit directement. [5] Le brin retardé est synthétisé sous forme d’éléments d’Okazaki, qui sont reliés entre eux grâce à une ligase. |
Pour les cellules des êtres supérieurs, les chromosomes sont linéaires et très longs. Il existe de nombreuses fourches de division qui sont dispersées le long de chaque chromosome, de façon à en accélérer la duplication
Le Software : les enzymes de réplication
Une première étape pour la réplication du DNA est constituée par les changements de forme topologique.
Le DNA d’un chromosome qui peut mesurer jusqu'à 1 m déroulé en totalité, change sa forme super enroulée pour passer à une forme moins enroulée, dans laquelle il est accessible aux autres enzymes .
Deux enzymes agissent à ce niveau :
- la topoisomérase de type I coupe l'un des deux brins du DNA, le DNA peut se dérouler en une forme B, puis survient une nouvelle ligature du DNA.
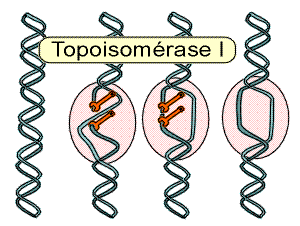 |
| Schéma de l’action de la topoisomérase I qui permet de cliver momentanément un brin du DNA et libère ainsi les forces de torsion pour un accès du DNA aux différents facteurs de transcription. |
- la topoisomérase de type II agit en coupant les deux brins du DNA (extrémité 3’ du DNA), et joue un rôle dans le relâchement des boucles pour la transcription semi réplicative.
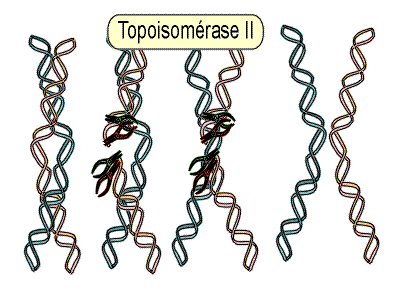 |
| Schéma de l’action de la topoisomérase II |
Après cette étape, des hélicases séparent les deux brins de DNA. Puis, des polymérases sont actives, commençant la synthèse par un brin du DNA (du côté 3' : brin direct), complétant ensuite sur le brin retardé, à travers une RNA primase. Chez l'homme, toutes les enzymes impliquées ne sont pas totalement connues : on distingue des polymérases a, b, g, d et e n'ayant pas toutes les propriétés des polymérases des procaryotes.
Des protéines accessoires de la réplication existent chez l'homme : le PCNA (Proliferating Cell Nuclear Antigen) est le premier décrit. Il s'agit d'un puissant activateur de la polymérase d, stimulé lors de la division cellulaire. Le PCNA semble avoir aussi un rôle dans la réparation des anomalies du DNA (cf. plus bas).
Les télomères
Les télomères, ou extrémités des chromosomes, sont indispensables pour préserver l’intégrité du matériel génétique au cours du cycle cellulaire.
L’ADN télomérique est formé par des répétitions très régulières, en tandem, d’un motif simple de 5 à 8 paires de bases riches en guanine. Les télomères ne peuvent pas être inversés, et la répétition des guanines se traduit par la constitution de boucles, de tiges ou de structures à quatre brins, très stables. La perte du télomère ou son absence de réparation entraîne une instabilité du chromosome qui se perd dans les cellules survivantes. Si elle n’est pas réparée, cette dégradation aboutit à l’arrêt du cycle cellulaire et à la mort de la cellule.
 |
| Schéma d’un télomère en épingle. Le fragment 5’ se termine normalement. En [1], le fragment 3’ se recourbe en épingle. Les guanines [2] se combinent entre elles par une modification de leur configuration des sucres associés. L’extrémité est ainsi protégée de la dégradation par les DNAses. |
Du fait des mécanismes de réplication de l’ADN, la réplication de ses extrémités peut être incomplète, aboutissant à une dégradation progressive des répétitions télomériques. La division se poursuit, mais les chromosomes se raccourcissent un peu plus à chaque mitose, ce qui aboutit, au bout d’un certain nombre de divisions, à une absence de répétition télomérique et une perte de la capacité de se multiplier. Ainsi, les fibroblastes normaux en culture se divisent environ 100 fois, puis meurent. Le segment tronçonné correspond à environ 50 à 200 paires de base, selon des séquences TTGGGG.
|
|
|
Perte de l’extrémité télomérique [1] A chaque division cellulaire de l’extrémité 3’ du DNA linéaire d’un chromosome. du fait de la traduction allant de 5’ en 3’, il est nécessaire d’avoir une amorce de RNA et une primase pour démarrer la traduction. (2] La traduction a commencé. [3] L’amorce RNA est supprimée laissant potentiellement un ‘trou’ par lequel le DNA pourrait être dégradé. [4] L’extrémité télomérique nouvelle se recourbe pour faire une extrémité en ‘épingle de cheveux’, comme dans la figure précédente. |
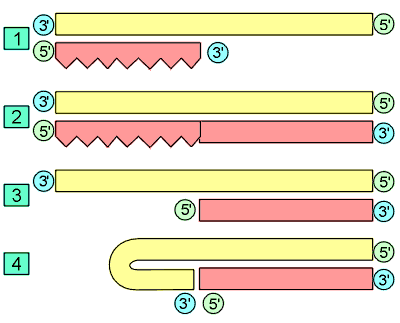
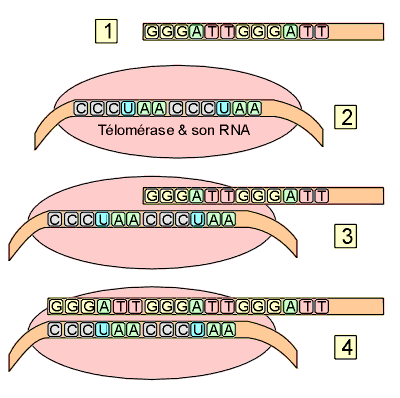
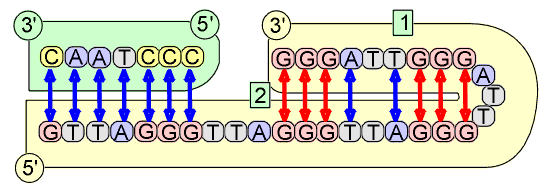
La télomérase est une ribonucléoprotéine, dont le gène se situe sur le chromosome 3, indispensable pendant la vie embryonnaire, qui stabilise les télomères en ajoutant des séquences TTAGGG aux extrémités des chromosomes, compensant le raccourcissement télomérique lié aux mitoses. On observe une élongation du télomère à partir d’une matrice de RNA incluse dans la télomérase.
|
|
|
Activité de la télomérase : [1] Le fragment terminal télomérique avec la répétition des segments GGGATT. [2] La télomérase inclut dans sa molécule un fragment de RNA comportant la séquence opposée : CCCUAA, au moins en double exemplaire. [3] La télomérase se fixe par l’intermédiaire de son RNA sur le télomère. [4] Une synthèse de DNA avec le nouveau segment GGGATT est fabriqué, allongeant de nouveau le brin 3’ de la longueur de ce segment. Plusieurs segments peuvent ainsi être rajoutés. |
La télomérase est normalement exprimée dans les cellules souches germinales, au cours de l’embryogenèse et au niveau des cellules souches originelles. Elle n’est pas exprimée dans les cellules normales différenciées.
On retrouve une activité télomérasique importante dans les cellules hautement malignes, et la présence de télomérase serait un indice de mauvais pronostic.
Une voie thérapeutique nouvelle peut également être recherchée par des substances à activité anti-télomérase qui serait très spécifiques des tumeurs malignes.