Aspects de l'évolution des gènes HLA
Aspects de l'évolution des gènes HLA
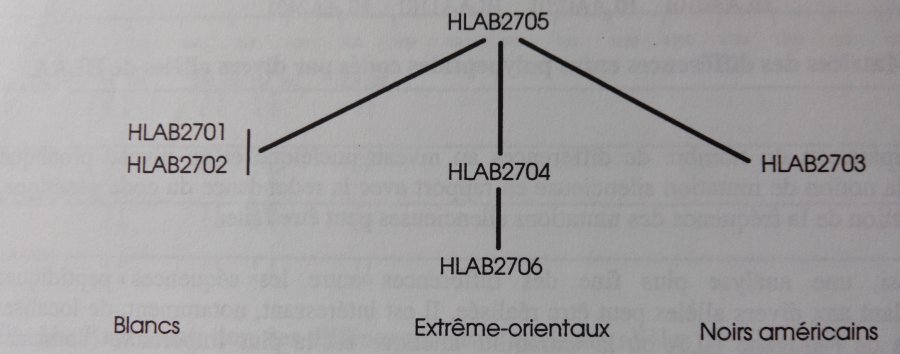
a - Considérons en premier les allèles correspondant à la spécificité HLA B27. L'allèle HLA B2705 est répandu dans toutes les populations étudiées (90% des allèles HLA B27 chez les blancs européens et 45% chez les extrême-orientaux).
Les allèles HLA B2701 (rare) et HLA B2702 (près de 10%) n'ont été trouvés que chez les blancs. HLA B2704 et HLA B2706 sont restreints aux extrême-orientaux (les allèles HLA B2704 représentent près de 55% des allèles HLA B27 dans ces populations). L'allèle HLA B2703, très rare, n'a été trouvé que chez les noirs américains.
Les associations entre tels allèles et telles populations indiquent que les allèles HLA B2701 et HLA B2706 sont apparus après diversification des populations. On peut penser que l'allèle HLA B2705, présent avec une fréquence élevée dans toutes les populations, était l'allèle initial dans les premières populations humaines.
En estimant que deux allèles sont d'autant plus apparentés que les différences entre leurs séquences sont minimes, on peut construire une représentation graphique traduisant la filiation entre allèles qui s'accorde bien avec les données de génétique des populations résumées plus haut.
b - Envisageons maintenant le problème de façon plus générale en considérant l'ensemble des spécificités d'un locus. Comment rendre compte d'un tel polymorphisme et du grand nombre de différences entre les séquences nucléiques de beaucoup de ces allèles ?
Puisqu'un allèle provient d'une mutation d'un allèle préexistant, on pourrait supposer que les caractéristiques précédentes résultent d'une fréquence de mutation élevée des gènes HLA. Diverses données laissent à penser qu'il n'en est rien. En particulier, au cours des analyses génétiques familiales, on n'a jamais constaté le cas d'un enfant ayant un allèle HLA que ne posséderait pas l'un de ses parents.
Klein (Origin of major histocompatibility complex polymorphism: The trans-species hypothesis. Human Immunology, Volume 19, Issue 3, July 1987, Pages 155-162) a proposé une autre explication : une grande partie du polymorphisme HLA n'aurait pas été acquise après la spéciation de l'Homo sapiens sapiens mais serait héritée des espèces ancestrales. Seul le polymorphisme des séquences relatives à une même spécificité sérologique (HLA B27 par exemple) serait post-spécifique. Cela revient à dire que les premières populations d'Homo sapiens sapiens possédaient plusieurs allèles à chaque locus HLA hérités de Homo erectus. Suivant cette hypothèse trans-spécifique, les allèles HLA de l'Homme moderne peuvent remonter à des espèces ancestrales relativement reculées.
Récemment, l'analyse au niveau moléculaire du CMH du Chimpanzé a fourni des données corroborant cette hypothèse. Chez le Chimpanzé comme chez l'Homme, il y a 3 locus polymorphiques pour les antigènes de classe I. On s'est aperçu que le degré de similitude entre les allèles CHLA A du chimpanzé (CH pour Chimpanzé) et des allèles HLA A humains était plus grand qu'entre certains allèles humains. Ainsi, la séquence codante du CHLA 108 du Chimpanzé ne diffère que par 15 nucléotides de celle de l'allèle humain HLA A11, alors que celles de HLA A11 et HLA A2 présentent 50 différences. On est amené à conclure que l'origine des allèles HLA A11 et HLA A2 est antérieure à la divergence de la lignée humaine et de celle du Chimpanzé.
