Nature du domaine scFv et spécificité du CAR
II - Une immunothérapie récente : Les cellules CAR-T
5 - Nature du domaine scFv et spécificité du CAR
Le CAR est un récepteur synthétique fabriqué par les généticiens, dont l’efficacité dépend de sa reconnaissance d’un antigène tumoral par son domaine scFv (single-chain fragment variable). Celui-ci est spécifique d’un antigène tumoral.
Les cellules CAR-T utilisées pour éliminer les cellules cancéreuses dans la leucémie aigüe lymphpoblastique (LAL) ont des récepteurs CAR anti-CD19. CD19 est une molécule membranaire des lymphocytes B, présente aussi dans leurs précurseurs de la moelle osseuse. Ces molécules CD19 sont aussi fréquentes dans la membrane des lymphoblastes cancéreux de la LAL. En revanche, elles ne sont quasiment pas exprimées dans les autres types de cellules de l’organisme.
En s’appuyant sur l’exemple de la LAL, les documents permettent d’établir comment le domaine scFv d’un CAR reconnaît un antigène tumoral, initiant ainsi l’activation de la cellule CAR-T qui aboutit à la lyse de la cellule cancéreuse.
Documents 13 : Structure et rôle du domaine scFv d’un CAR
Document 13a : vue simplifiée d’un lymphocyte B reconnu par une cellule CAR-T
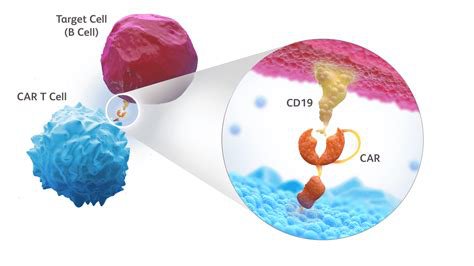
Source : CD19-directed chimeric antigen receptor (CAR) T cell. BMS science.
Noter que la cellule cible de ce document n’est pas une cellule cancéreuse.
Document 13b : rappels sur la structure d’un anticorps et sa propriété de base
Le document 12c2 suggère que le domaine scFv du récepteur CAR a une structure qui évoque celle d’une région d’un anticorps.
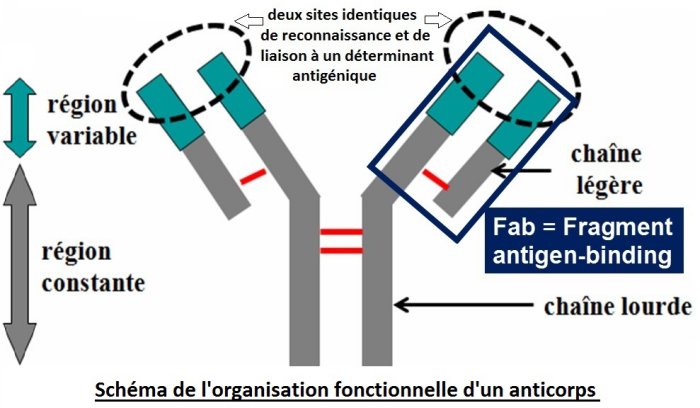
Source : Spécificité des anticorps. Anne Florimond.
Propriété d’un anticorps
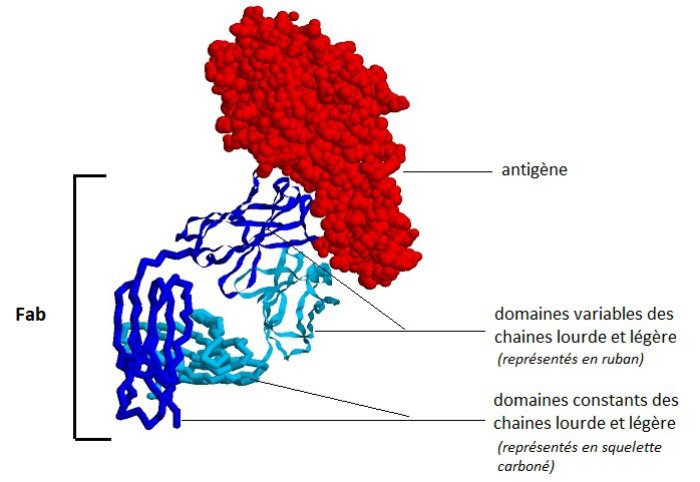
L’image obtenue avec Rastop est une représentation tridimensionnelle d’un segment Fab d’un anticorps anti-lysosyme de souris et de son antigène.
Source : Spécificité des anticorps. Anne Florimond.
Document 13c :
Fichier pour Anagène : (Séquences CAR.edi)
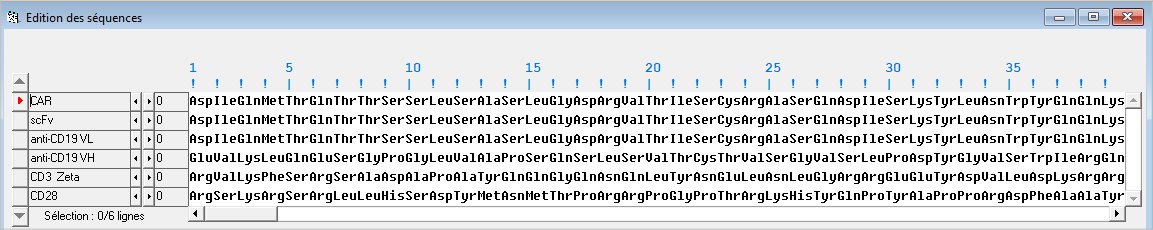
CAR séquence du récepteur CAR ; scFv séquence du récepteur CAR reconnaissant l’antigène ; anti CD19 VL : séquence du fragment variable de la chaîne légère d’un anticorps CD19 ; anti CD 19 VH : séquence du fragment variable de la chaîne lourde d’un anticorps anti CD19 ; CD3 zeta : séquence de la chaîne CD3 zeta associée au récepteur TCR d’un lymphocyte T ; CD28 : séquence d’un facteur de costimulation associé au récepteur TCR d’un lymphocyte T.
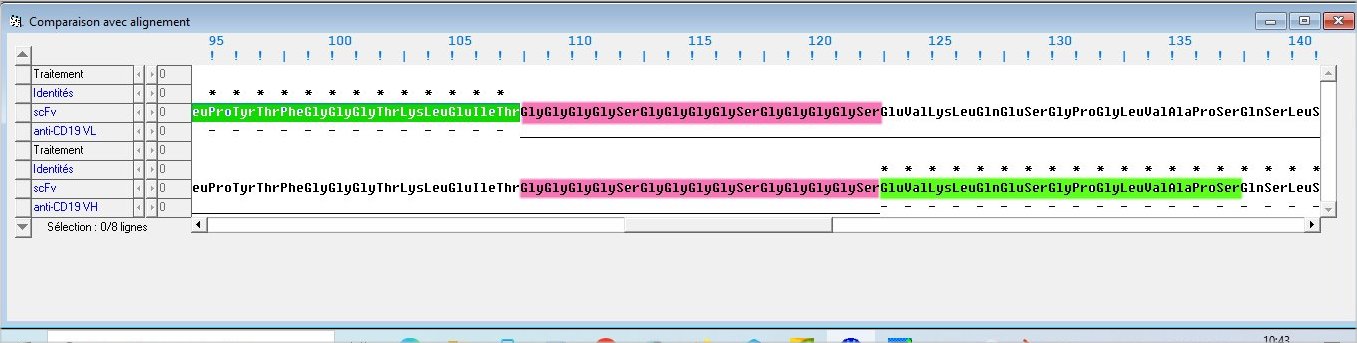
Document 13c1 : Comparaison de la séquence du scFv d’un récepteur CAR anti-CD19 avec celles d’un segment variable de la chaîne lourde et de la chaîne légère d’un anticorps anti-CD19
Document 13d : Visualisations en 3D de l’interaction entre le scFv anti-CD19 et l’antigène CD19
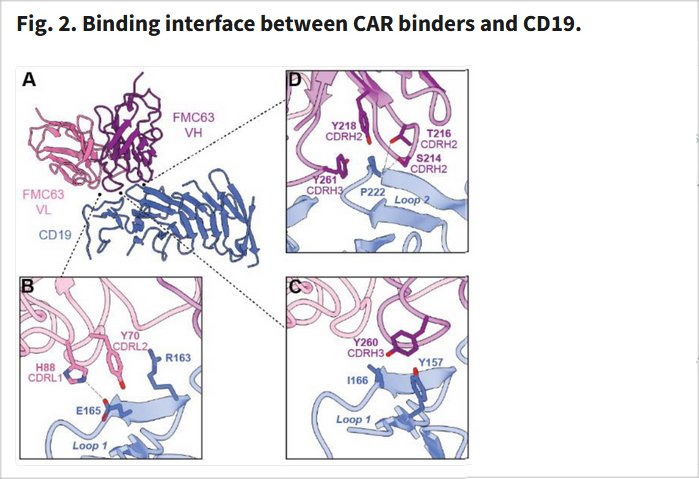
: CD19 CAR antigen engagement mechanisms and affinity tuning. Binding interface between CAR binders and CD19. Sci Immunol. 2023 Mar. Fig. 2.
Les cadres B, C et D précisent les aa impliqués dans les 3 interfaces de liaison pointés en A. (A to D) Molecular model of FMC63 in complex with CD19 (A). The VL domain of FMC63 contacts CD19 with residues of CDRL1 and CDRL2 (B). The VH domain forms most of the contacts for FMC63, and these are mediated by residues in CDRH2 and CDRH3 (C and D).
Pistes de questionnement :
- Comparer la séquence du scFv d’un récepteur CAR anti-CD19 avec celles des domaines variables VL et VH d’un anticorps anti-CD19.
- A partir de cette comparaison, indiquer la composition du scFv d’un récepteur CAR et l’origine de sa spécificité vis à vis d’une cellule tumorale.
 |
