3 - Comparaison de l’action du virus Sars-Cov-2 et d’une nanoparticule anti-covid dans des cellules de l’organisme
3 - Comparaison de l’action du virus Sars-Cov-2 et d’une nanoparticule anti-covid dans des cellules de l’organisme
A - Données et questionnements
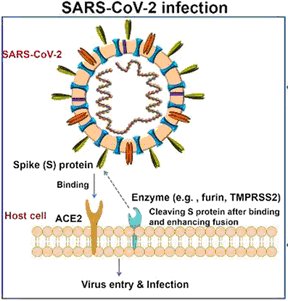
3a - Entrée du virus SARS-CoV-2 dans ses cellules cibles
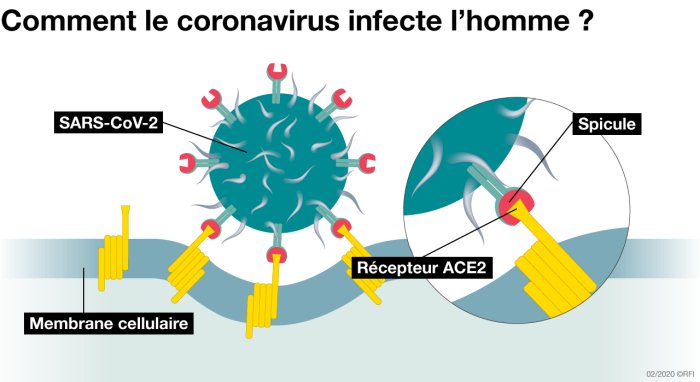
Spicule désigne la protéine « spike » du virus.
D’après : Le coronavirus en 7 points. RFI. Mise à jour : 12/02/2020.
Toutes les cellules de l’organisme ne possèdent pas le récepteur ACE2 membranaire. La densité des récepteurs ACE2 est importante dans les cellules de l’appareil respiratoire.
3b - Vue globale des évènements de l’action du virus dans les cellules qu’il infecte
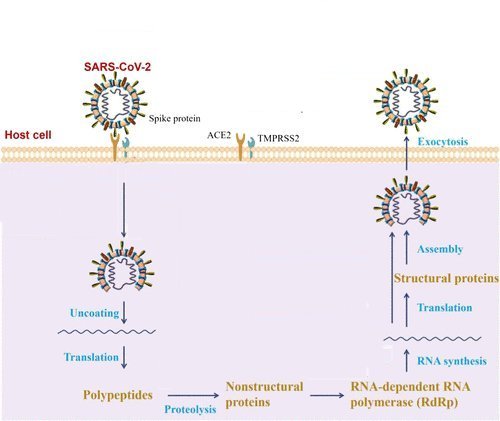
Source : D'après Zilong Mao et al. New Insights from Chemical Biology: Molecular Basis of Transmission, Diagnosis, and Therapy of SARS-CoV-2. CCS Chem. 2021, 3.
3c - Entrée d’une nanoparticule anti-Covid 19 dans une cellule humaine
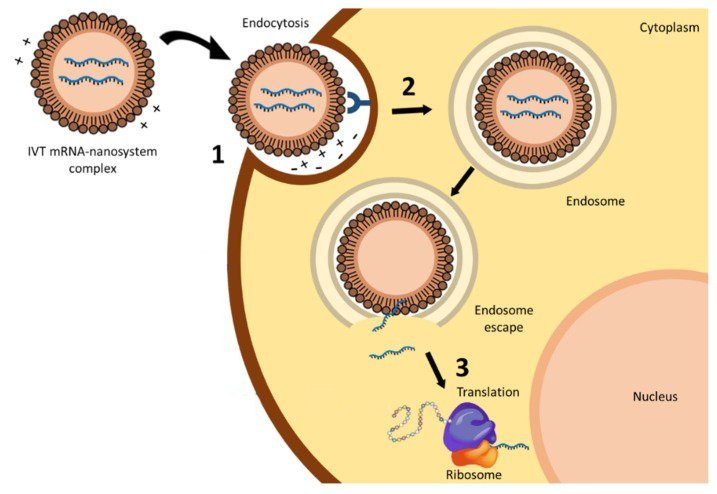
et al. Nanomedicines to Deliver mRNA : State of the Art and Future Perspectives. Nanomaterials février 2020.
3d - De la production in vitro d’ARNm anti-covid à celle de protéine vaccinale par des cellules de l’organisme
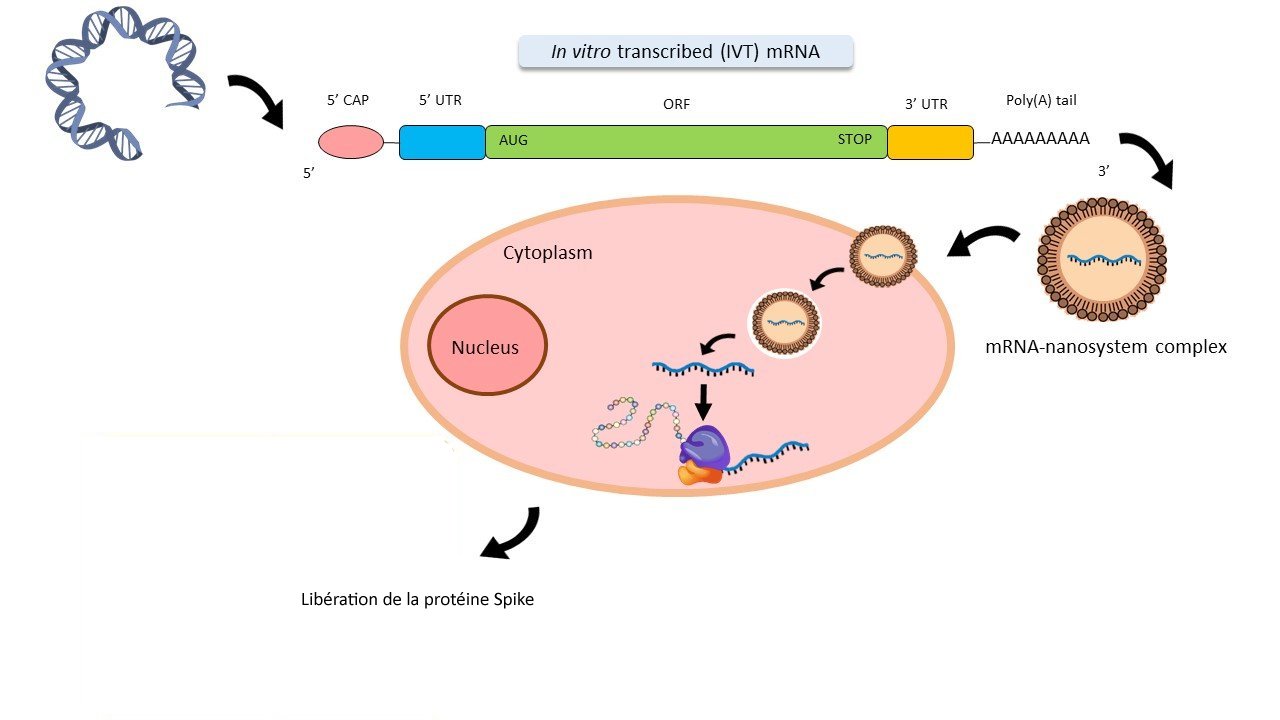
et al. Nanomedicines to Deliver mRNA : State of the Art and Future Perspectives. Nanomaterials février 2020.
Questionnements
- Indiquer les premières étapes communes au SARS-CoV-2 virus et à une nanoparticule vaccinale anti-covid-19 ; en préciser aussi les différences.
- Indiquer les données qui montrent que dans les deux cas, des organites cellulaires contribuent à l’action du virus et de la nanoparticule.
- Indiquer quel est le bilan de l’action des nanoparticules et donc cellui de l’ARN messager qu’elles possèdent par rapport à celui des virus SARS-CoV-2.
- Donner un argument en faveur de l’affirmation que les nanoparticules vaccinales ne peuvent modifier le génome des cellules dans lesquelles elles ont pénétré.
B - Commentaires et compléments
Les figures indiquent un caractère commun au début du mécanisme d’action du virus et de la nanoparticule, à savoir leur entrée dans des cellules de l’organisme.
- Le virus y réussit grâce aux protéines « spike » de son enveloppe capables de se lier à des récepteurs ACE2 situés dans la membrane de cellules cibles (notamment celles des épithéliums respiratoires (figure ci-après) Cette liaison entraîne la fusion de l’enveloppe du virus et de celle de la membrane plasmique, suivie par une entrée par endocytose du virus dans le cytoplasme de la cellule cible.
Les nanoparticules du vaccin anti-SARS-CoV-2 ne possèdent pas de protéine « spike ». Néanmoins, la combinaison des lipides de leur enveloppe leur permet de se lier à la membrane plasmique de cellules. Cela est suivi par leur entrée par endocytose dans le cytoplasme des cellules comme l’illustre la figure 3c.
Du fait de la présence ou non de récepteurs ACE2, les cellules dans lesquelles pénètrent le virus et la nanoparticule ne sont pas les mêmes. Au cours d’une injection intramusculaire du vaccin, les nanoparticules peuvent pénétrer dans les cellules musculaires mais aussi dans des cellules de l’immunité innée, les cellules dendritiques. Pour cette partie axée sur les propriétés de l’ARN messager, on peut considérer uniquement les cellules musculaires.
- Les figures 3b et 3c indiquent que l’ARN génomique pour les virus et l’ARN messager pour les nanoparticules sont libérés dans le cytoplasme des cellules. En exploitant la machinerie de synthèse des protéines de la cellule, en particulier les ribosomes, une traduction de leur génome a lieu. Elle est suivie d’un processus complexe de traductions et de la réplication du génome dans le cas du virus aboutissant à la production de virions libérés dans le milieu extracellulaire qui pourront infecter d’autres cellules.
Dans le cas de la nanoparticule, la traduction de l’ARN messager aboutit à la production de protéines « spike » émises dans le milieu extracellulaire du muscle en cas d’injection intramusculaire du vaccin.
- La figure 3d résume les différentes étapes de la biologie des nanoparticules envisagées jusqu’ici : fabrication d’un ARN messager synthétique codant la protéine spike, incorporation de cet ARNm dans une particule à enveloppe lipidique (LNP) vecteur de l’entrée de l’ARNm dans une cellule, traduction de cet ARN m par la cellule et production de protéines spike libérées hors de la cellule.
