Exploitation pédagogique. Deuxième partie
Introduction
L’implication du gène DMPK dans la maladie de Steinert (DM1) a été vue dans la première partie. Dans cette seconde partie du dossier, il s’agit de préciser la structure du gène ainsi que la nature des différences entre les allèles présents dans les populations.
En première, l’étude de la structure d’un gène d’eucaryote se limite très souvent à sa séquence codante et aux mutations qui l’affectent. En terminale, on envisage une structure plus complète. L’étude de la DM1 est bien adaptée dans cette perspective car la région du gène en cause dans les mécanismes pathologiques est en dehors de la séquence codante. C’est ce que suggère le titre de cette partie.
Rappel : Données et questionnements. Deuxième partie
 |
Deuxième partie : Le gène DMPK, un gène d’eucaryote avec des caractéristiques qui lui sont propres |
Exploitation pédagogique
Structure du gène DMPK
1 - Rappel d’un acquis de première sur l’expression d’un gène.
La structure d’un gène et son expression sont deux notions complémentaires. La figure du document 1 de « Données et documents » situe les différentes étapes de l’expression d’un gène d’eucaryote et on peut demander aux élèves d’indiquer le mécanisme en jeu à chacune des 4 étapes comme dans la figure ci-dessous.
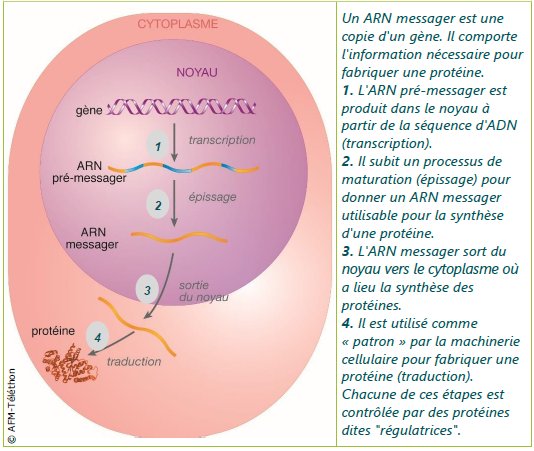
Les étapes de l'expression d'un gène
2 - Les séquences relatives au gène DMPK et la structure du gène.
L’exploitation de ces séquences doit permettre d’établir une vue complète et fonctionnelle de la structure du gène DMPK en conclusion. Certaines des séquences fournies sont exprimées à la fois en ADN et en ARN.
Fichier : DMPK-Séquences en ADN et ARN.edi
Bien entendu, il doit rester clair dans l’esprit des élèves qu’au sein des cellules, la séquence du gène est en ADN et les séquences relatives à son expression en ARN.
Si on regarde maintenant les conventions d’écriture des séquences dans les banques, on constate qu’elles privilégient l’écriture en ADN. C’est pour tenir compte de cela, que nous avons indiqué certaines séquences en ADN et en ARN. Alors que le gène est constitué par deux brins complémentaires, sa séquence dans les banques est celle d’un seul brin, celle du brin non transcrit. Elle est identique à celle de l’ARN issu de la transcription sauf que les nucléotides à thymine dans la séquence du gène sont remplacés par des nucléotides à uracile dans l’ARN. Cela fait qu’on peut ainsi convertir une séquence ADN en ARN
- La comparaison de la séquence du gène DMPK avec celle de son ARN pré-messager (séquence en ARN) permet de constater que toute la séquence de ce gène est transcrite en ARN par l’ARN polymérase suivant les modalités de la transcription.
- La comparaison des séquences de l’ARN pré-messager et de l’ARN messager (toutes deux en ARN) conduit à définir la notion d’épissage. C’est là qu’il est intéressant de convertir ces séquences en ADN et de déboucher sur les notions d’exons et d’introns. Le gène DMPK apparait ainsi comme un gène morcelé comprenant une quinzaine d’exons séparés par des introns. Ces derniers sont transcrits mais finalement éliminés. Ces caractéristiques sont traduites sur la figure par la couleur des segments de l’ARN. Dans l’ARN pré-messager les exons sont en jaune et les introns en bleu ; tout l’ARN messager est en jaune ce qui traduit l’élimination des introns ; il ne persiste que les exons.
- La séquence codante (CDS) dans les banques est écrite en ADN. Cependant, dans un premier temps, il faut prendre la séquence CDS en ARN pour une comparaison avec celle de l’ARN messager. En traduisant avec Anagène la séquence codante, on identifie, le codon d’initiation de la traduction AUG ainsi que le codon stop. La comparaison des séquences de l’ARN messager et du CDS met en évidence les régions en amont et en aval de la séquence codante qui sont des régions transcrites mais non traduites. Elles sont désignées par le symbole UTR (Untranslated Region) : 5’UTR pour la région en amont de la séquence codante, 3’UTR pour celle en aval.
La conversion de la séquence de l’ARN messager en ADN débouche sur un premier bilan de la structure fonctionnelle du gène, sans prendre en compte les séquences des introns. Elle débute par la séquence 5’UTR, suivie par la séquence codante, puis par la région 3’UTR.
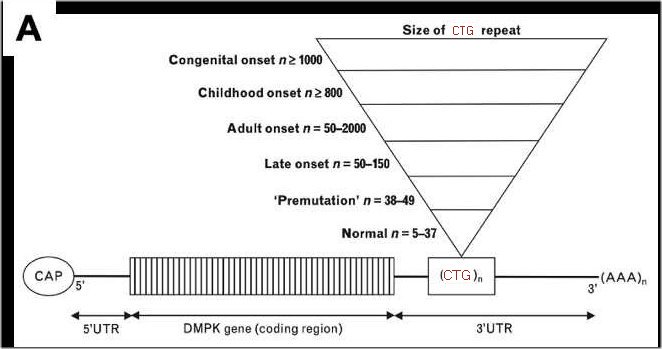
L’exploration des séquences UTR révèle la présence dans la région 3’UTR d’un triplet CTG répété de nombreuses fois. L’importance de cette répétition est mise n évidence dans le point suivant sur les différences entre les allèles du gène DMPK
3 - Différences entre les allèles du gène DMPK
Fichier : DMPK-Deux allèles.edi
- Comparaison des séquences de deux allèles (document 1)
La comparaison des deux allèles ne montre aucune différence entre leurs séquences codantes. Dans la région 3’UTR, des deux allèles, on remarque le triplet CTG répété de nombreuses fois. Mais les deux allèles diffèrent par le nombre de répétitions : 20 pour l’allèle A1 et 80 pour l’allèle A2. La corrélation entre le nombre de triplets et les phénotypes « sain » et « DM1 » conduit à émettre l’hypothèse que le phénotype de la DM1 est causé par un grand nombre de triplets CTG dans la séquence 3’ UTR du gène DMPK. En outre, le génotype de la personne « DM1 » confirme que c’est une maladie autosomale dominante.
- Relation entre le nombre de triplets et les formes de la maladie (document 2)
Les données du document permettent de tester l’hypothèse émise. On constate que, statistiquement, la DM1 est d’autant plus grave et précoce que le nombre de triplets CTG est grand. L’hypothèse est donc corroborée par ces données.
4 - Informations supplémentaires fournies par les arbres généalogiques
Les documents 3 et 4 reprennent les arbres envisagés dans la première partie du dossier mais en ajoutant cette fois des renseignements sur le nombre de triplets CTG de l’allèle « DM1 » des membres de la famille. Ces données confirment à nouveau que l’expansion du nombre de triplets CTG du gène DMPK est cause de la maladie mais seulement si elle est supérieure à 50 triplets.
Les deux arbres apportent une information complémentaire, à savoir que le nombre de triplets chez les personnes atteintes augmente de génération en génération. Cela traduit une instabilité du gène DMPK dans les cellules germinales des personnes « DM1 » qui se manifeste par des mutations d’amplification des triplets CTG dans la région 3’UTR du gène. Ces mutations sont cause du phénomène d’anticipation constaté dans les familles des deux arbres.
5 - Schéma bilan.
C’est un schéma fonctionnel qui n’intègre pas la structure en exons et introns non directement impliquée dans la maladie. Il traduit que ce ne sont pas des mutations de la séquence codante qui engendrent la maladie mais des mutations situées dans la région 3’UTR avec une expansion du nombre de CTG. Ce bilan introduit l’idée de prémutation chez les personnes où le nombre de triplets dans le gène DMPK est compris entre 38 et 49. Cela signifie que le nombre de répétitions de triplets est supérieur à la normale mais suffisamment faible pour ne pas se traduire par des manifestations cliniques. Mais par contre la région des triplets est devenue instable et a tendance à muter ce qui peut favoriser l’apparition de la maladie dans la descendance.
