Exploitation pédagogique troisième partie
Introduction
En première et en terminale, on envisage classiquement les conséquences des mutations de la séquence codante d’un gène sur celle de la séquence de la protéine codée par ce gène. On établit ainsi le changement du phénotype moléculaire provoqué par la mutation et sa répercussion à l’échelle cellulaire et de l’organisme.
Les mutations du gène DMPK causes de la DM1 n’affectent pas la séquence codante du gène et donc celle de la protéine DMPK. Le problème est donc de comprendre comment des mutations situées dans la région 3’UTR du gène, en dehors de la séquence codante, peuvent avoir des effets pathologiques sans modifier la séquence de la protéine DMPK. Il s’agit donc de trouver comment l’expansion du triplet CTG dans la région 3’UTR du gène affecte les phénotypes moléculaire et cellulaire des cellules.
Rappel : Données et questionnements. Troisième partie
 |
Troisième partie : Mécanismes moléculaires de la pathogénèse |
Exploitation pédagogique.
Mécanismes moléculaires de la pathogenèse
Parmi les hypothèses explicatives émises, deux d’entre elles ont la faveur des chercheurs. La première dite de l’haploinsuffisance, suppose que si la protéine DMPK n’est pas modifiée, sa quantité est diminuée. Autrement dit, l’allèle muté avec un grand nombre de répétitions du triplet CTG entraînerait une baisse de la quantité de la protéine.
La deuxième dite des ARN messagers toxiques, suppose que ce sont les ARN résultant de la transcription des allèles DMPK mutés, qui seraient anormaux induisant un dérèglement du fonctionnement cellulaire.
Les documents fournis ont pour objectif de tester ces hypothèses et de placer ainsi les élèves dans une pratique de démarche scientifique.
A. La quantité de protéines DPMK des cellules musculaires
Les données du document 1 indiquent que, statistiquement, la quantité de protéines DMPK dans les cellules musculaires d’une personne DM1 est la moitié de celle d’une personne « saine ». Cela corrobore l’hypothèse de l’haploinsuffisance. Toutefois, on constate qu’il n’y a pas de corrélation entre le nombre de triplets CTG de l’allèle muté et la quantité de protéines DMPK. Cela suggère que l’haploinsuffisance n’est pas la seule cause de la DM1.
B. Le comportement des ARN messagers des allèles DMPK « sains » et mutés (document 2)
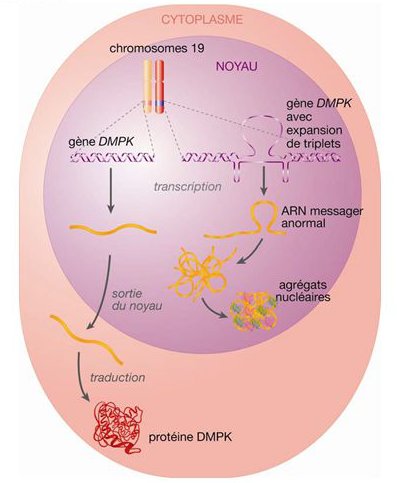
- En haut de la figure 2a, on a représenté les chromosomes 19, l’un porteur d’un allèle « sain » du gène DMPK, l’autre d’un allèle muté chez une personne DM1. On peut suivre de façon comparative les étapes de l’expression de ces deux allèles, à gauche pour l’allèle « sain », à droite pour l’allèle muté. La figure rappelle en premier la différence entre les séquences des deux allèles (plutôt que gène DMPK, on devrait dire allèle DMPK). Les mécanismes de transcription et d’épissage des deux allèles sont les mêmes de sorte que les différences entre les allèles se retrouvent au niveau de leurs ARN messagers. Par rapport à l’ARN messager normal de l’allèle sain, celui de l’allèle muté qualifié « d’anormal » comprend dans sa séquence 3’UTR, en aval de sa séquence codante, une expansion de triplets CUG.
En bas de la figure 2a le comportement des deux ARN messagers est ensuite comparé. Celui de l’allèle « sain » quitte le noyau, passe dans le cytoplasme où il est traduit en protéine DMPK. En revanche, les molécules d’ARNm anormal forment des agrégats, s’accumulent dans le noyau et ne sont pas exportés dans le cytoplasme. Par conséquent l’expression de l’allèle muté n’aboutit pas à la production de protéine DMPK. Cela explique la diminution de la quantité de la protéine DMPK dans les cellules d’une personne DM1 et conforte l’hypothèse de l’haploinsuffisance sans expliquer toutefois comment elle engendre des symptômes de la DM1.
L’étude de la maladie de Steinert mobilise ainsi les connaissances de première sur l’expression des allèles d’un gène. Elle les enrichit en envisageant les conséquences de mutations dans une région non codante caractérisées par une expansion de triplets.
- Le document 2b révèle que les expansions CUG des molécules d’ARNm anormal forment des structures en boucles, en épingles à cheveux. Ce sont ces structures qui en s’enchevêtrant forment les agrégats nucléaires (encore appelés foci). Dans le noyau des cellules DM1 ces agrégats ont des conséquences pathologiques qui sont envisagées dans le document 3.
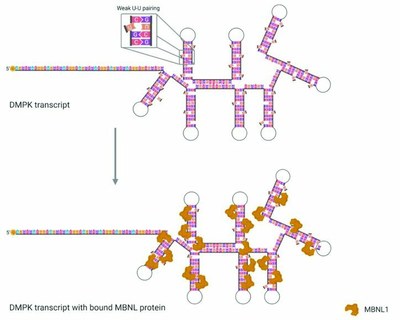
C. La séquestration des protéines MBNL1 par les agrégats d’ARNm. (Document 3)
Les protéines MBLN1 sont des protéines localisées dans le noyau qui régulent l’épissage des ARN pré-messagers de plusieurs gènes intervenant dans le métabolisme des cellules.
- Les figures 2a et 3b montrent que ces protéines se lient aux triplets CUG des structures en épingles à cheveux des agrégats d’ARNm anormal, ce qui est traduit par le terme de séquestration.
- La figure 3c en indique les conséquences : La quantité de protéines MBNL1 libres dans le nucléoplasme des cellules musculaires de personnes DM1 est nettement moindre que chez des personnes « saines ».
D. La toxicité des ARNm des allèles mutés du gène DMPK est confortée
Le document 4 résume le mécanisme par lequel un allèle DMPK caractérisé par une expansion du nombre de triplets CTG dans sa région 3’UTR affecte la cellule où il s’exprime. Sa transcription conduit à des transcrits mutants (ARNm anormaux) qui forment des agrégats dans le noyau des cellules. Ceux-ci sont à l’origine des dysfonctionnements dans différents types cellulaires mentionnés en bas de ce document 4. Cela corrobore l’hypothèse de la toxicité des ARNm des allèles mutés, considérée comme la principale cause des symptômes de la DM1.
Conclusion
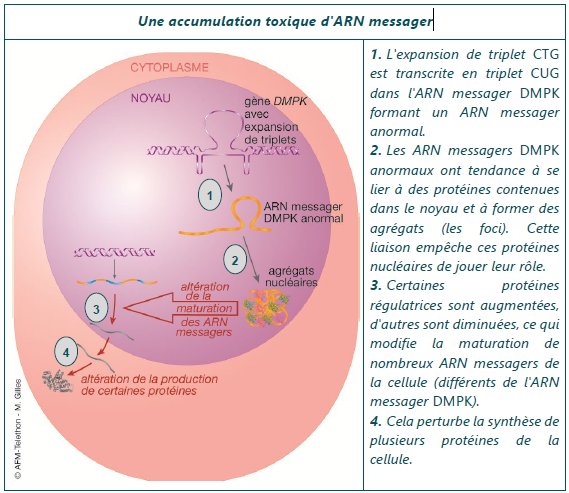
La figure traduit la façon dont un allèle muté du gène DMPK exerce des effets pathologiques sur le fonctionnement des cellules. On n’a représenté qu’un seul allèle du fait que la DM est une maladie dominante.
Le premier point est que la transcription de cet allèle aboutit à la formation d’agrégats nucléaires à partir des ARNm anormaux de l’allèle.
Une conséquence de ces agrégats est que les molécules d’ARNm ne sont pas exportées dans le cytoplasme et ne sont donc pas traduites. Cette réduction de la production de protéines DMPK peut avoir un impact dans la cellule mais reste encore mal connu.
Une autre conséquence, plus importante, est la séquestration de protéines, notamment les protéines MBNL1 par les agrégats d’ARNm anormaux. Cela entraîne une réduction de la quantité de protéines MBNL1 libres ce qui affecte l’épissage des ARN-pré messagers de plusieurs gènes. Cela est traduit à gauche par l’expression d’un gène dont l’épissage est modifié par la réduction de protéines MBNL1. Les ARNm de ces gènes sont anormaux et leur traduction dans le cytoplasme conduit à des protéines dont la séquence d’acides aminés est modifiée et la fonction déréglée.
Quelques-uns de ces gènes sont indiqués sous la figure. On s’aperçoit que la maladie DM est systémique : si elle affecte toujours les cellules musculaires, elle touche d’autres types cellulaires et ses manifestations sont diverses.
