Stratégies thérapeutiques
Données et questionnements. Cinquième partie
Des stratégies thérapeutiques récentes
03/02/2025 : AFMTéléthon. Une montée en puissance des essais dans la DM1.
A - Introduction
Les recherches les plus récentes ayant pour objectif d’aboutir à des protocoles assurant la guérison de la maladie de Steinert s’appuient sur les connaissances acquises depuis le début des années 2000 sur les mécanismes moléculaires en jeu au sein des cellules entraînant les symptômes de la DM1.
La figure suivante fournit une vue d’ensemble des étapes de ces mécanismes et indique les voies thérapeutiques possibles.
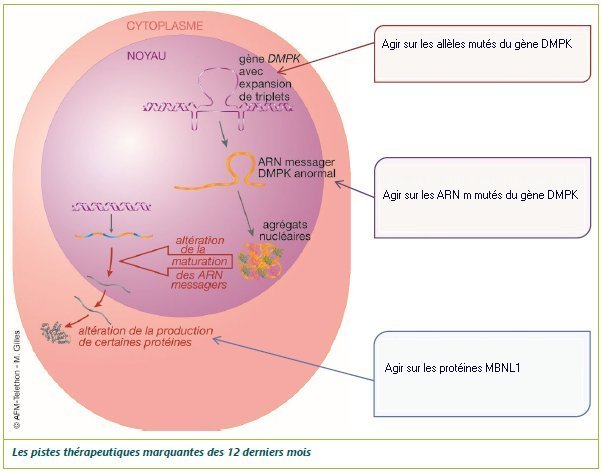
Source : Avancées dans la maladie de Steinert. AFMTHELETHONJUIN 2022
Questionnement
A l’aide des connaissances sur les mécanismes pathologiques de la DM1, indiquer la nature des actions qui pourraient aux trois niveaux contribuer à rétablir un fonctionnement normal des cellules musculaires.
B - Une thérapie génique prometteuse sur un modèle cellulaire
1 - Protocole expérimental
Les pistes thérapeutiques avant d’être validées chez l’Homme dans le cadre d’essais cliniques doivent être testées sur des modèles cellulaires et animaux.
- Les acteurs cellulaires et moléculaires
Les chercheurs ont travaillé sur des cultures de cellules musculaires obtenues à partir de patients ayant la maladie de Steinert. Ces cellules possédaient donc les caractéristiques moléculaires de la DM1 : nature des mutations, conséquences pathologiques de ces mutations, notamment la toxicité des ARN messagers du gène DMPK qu’elles entraînent.
Ils ont conçu par ingénierie la synthèse d’une protéine qu’ils ont nommée MBNL1Δ.
- Le protocole
A l’aide d’un vecteur viral muni de la construction génétique dont l’expression conduit à la synthèse de la protéine MBNL1Δ, les chercheurs ont obtenu des cellules DM1 possédant au sein de leur noyau cette protéine. Ils ont recherché si cette protéine qu’ils ont qualifiée de leurre avait un impact sur la pathologie des cellules DM1. Pour cela, ils ont étudié l’épissage de divers ARN pré-messagers de plusieurs gènes dont le gène DMD qui code pour la dystrophine. Ce gène comme la grande majorité des gènes eucaryotes est soumis à un épissage alternatif. Cela signifie que l’assemblage des exons qui conduit à l’ARN messager varie notamment suivant les types cellulaires. Lorsqu’un exon se retrouve dans l’ARN messager, on parle d’inclusion ; lorsqu’il est absent de l’ARN messager, on utilise le terme d’exclusion. Les protéines MBNL1 interviennent dans la régulation de l’épissage alternatif des gènes.
2 - Documents
- Séquences des protéines MBNL1 et MBNL1Δ
Dans la séquence de la protéine MBNL1, on reconnait deux régions. La première située en amont lui confère la capacité de se lier aux expansions des triplets CUG des ARN messagers. La seconde lui confère la capacité à réguler l’épissage alternatif des ARN pré-messagers de nombreux gènes.
Fichier : MBNL1.edi
- Epissage de l’exon 78 du gène DMD et protéine MBNL1Δ
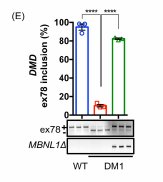
En ordonnée on a le pourcentage d’inclusion de l’exon 78 et cela chez 3 types de cellules : cellules « saines » (WT) dont l’épissage de cet exon est considéré comme étant la norme ; cellules DM1, cellules DM1 possédant la protéine MBNL1Δ.
- Modalités de l’action de MBNL1Δ.
En poursuivant leurs travaux, les chercheurs ont voulu déterminer les mécanismes par lesquels, la protéine MBNL1Δ affectait les cellules DM1 et notamment rétablissaient au moins partiellement l’épissage d’ARN messagers pour cela, durant les 8 heures qui ont suivi le début d’expression de la protéine MBNL1Δ dans les cellules DM1, ils ont analysé l’évolution de plusieurs paramètres de ces cellules
- Localisation des protéines MBNL1Δ dans les cellules
Ils ont constaté que ces protéines se localisaient dans les agrégats nucléaires (foci) en se liant aux triplets CUG de l’expansion des ARN messagers du gène DMPK. Leur concentration dans les foci a augmenté au cours des 8 heures.
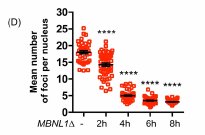
Evolution de la quantité de protéines MBNL1 séquestrées par noyau (unités arbitraires)

Evolution de l’épissage de l’exon 78 du gène DMD (pourcentage d’inclusion)
Questionnement
- Comparer les séquences des protéines MBNL1 et MBNL1Δ ; à partir des informations sur les propriétés de la protéine MBNL1, indiquer celle qu’on doit retrouver chez la protéine MBNL1Δ.
- A partir de l’exploitation de certains documents, indiquer les données qui montrent que la protéine MBNL1Δ contribue à atténuer les symptômes pathologiques des cellules DM1.
- Schématiser la disposition des protéines MBNL1 et MBNL1Δ sur les triplets CUG des expansions pathologiques des ARN messagers du gène DMPK aux temps 0,3 et 8 minutes (pour cela, on peut s’inspirer du schéma 3c de la partie sur les mécanismes moléculaires de la pathogenèse).
- Indiquer au temps 8 minutes, la localisation des protéines MBNL1 dans la cellule et les fonctions qu’elles peuvent assurer. En bilan indiquer comment les protéines MBNL1Δ peuvent contribuer à la restauration des propriétés des cellules DM1.
C - Essai d’application de cette thérapie sur un modèle animal, in vivo.
Les chercheurs ont voulu savoir si les constats faits sur un modèle cellulaire se retrouvaient sur un modèle animal.
1 - Les acteurs de l’expérimentation
a. Le modèle animal
Les chercheurs ont expérimenté sur des souches de souris présentant les même symptômes que ceux de la maladie de Steinert humaine, en particulier les mêmes caractéristiques moléculaires. Ces souris sont aussi désignées souris DM1 et possèdent dans la région 3’UTR 220 répétitions du triplet CTG.
b. Le protocole expérimental
Ils ont utilisé un vecteur viral de thérapie génique AAV9. Dans la séquence de ce vecteur, ils ont inséré une séquence codant pour la protéine MBNL1Δ. Ils ont d’abord réalisé une injection locale de cette construction génétique dans un muscle gastrocnémien de souris DM1 et une injection d’une solution saline dans le gastrocnémien du côté opposé. Le vecteur viral permet l’introduction de la séquence de la protéine dans les cellules musculaires et son expression dans les noyaux.
Par la suite les chercheurs ont étudié les caractéristiques des cellules musculaires traitées, en particulier celles de l’épissage des ARN pré-messagers de gènes et celles de la myotonie. La myotonie est un symptôme fréquent chez les patients DM1 caractérisé par la lenteur de relâchement d’un muscle après sa contraction. Elle se manifeste par la difficulté à lâcher un objet après l’avoir empoigné, par la lenteur à ouvrir la main après l’avoir serrée. La mesure du temps de relaxation renseigne sur l’intensité de la myotonie.
2. Résultats
Documents
- Doc 2A - Epissage d’un exon chez 3 gènes : Clcn1 ; Atp2a1, Mbnl1
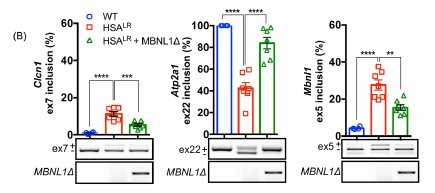
En ordonnée : % d’inclusion de l’exon 7 du gène Clcn1 ; pourcentage d’inclusion de l’exon 22 du gène Atp2a1 ; pourcentage d’inclusion de l’exon 5 du gène Mbnl1. A noter que le gène MBNL1 qui code pour une protéine MBNL1 qui agit sur la maturation des ARN messagers des autres gènes, est lui-même soumis à un épissage alternatif. Noter qu’on retrouve les mêmes couleurs que dans les graphes précédents correspondant aux trois types cellulaires : cellules saines, cellules dm1, cellules DM1+MBNL1Δ.
Le résultat est le même 7 semaines et un an après le début de l’expérimentation.
- Doc 2B : Temps de relaxation en ms du muscle gastrocnémien de souris DM1 ayant reçu une injection du gène codant pour la protéine MBNL1Δ et de celui ayant reçu une injection de solution saline. Les temps de relaxation des mêmes muscles chez une souris « sauvage » sont indiqués par le rectangle bleu.
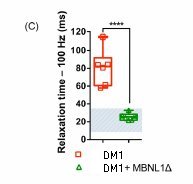
Les résultats sont les mêmes 7 semaines et un an après le début de l’expérimentation.
D. Effets de l’injection par voie systémique de la protéine MBNL1Δ
1 - Le protocole expérimental
Les chercheurs ont ensuite expérimenté pour voir si la construction génétique comprenant la séquence du virus AAV9 dans laquelle est insérée la séquence codant pour la protéine MBNL1Δ gardait son efficacité si elle était injectée par voie systémique dans des souris DM1. La voie systémique est un mode d’administration d’un médicament injecté par voie veineuse ; le médicament diffuse dans tout l’organisme via la circulation sanguine et atteint ainsi tous les muscles.
Les chercheurs ont étudié les caractéristiques des muscles gastrocnémiens de souris DM1 ainsi traitées
2 - Résultats
a - Document 1

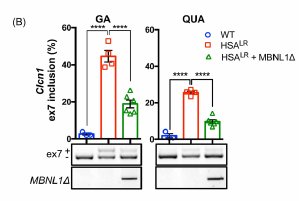
Pourcentage d’inclusion de l’exon 7a du gène Clcn1 dans les cellules des muscles gastrocnémiens et quadriceps 7 semaines après le début de l’expérimentation
Bleu : souris sauvage
Rouge : souris DMI ayant été traitée par injection d’une solution saline
Vert : souris DMI traitée par l’injection systémique de la protéine MBNL1Δ
b - Document 2

Temps de relaxation en ms de muscle gastrocnémien de souris DMI 7 semaines après l’injection de la construction génique AAV9-MBNL1Δ comparé à celui de souris ayant reçu une injection de solution saline. Le rectangle bleu traduit les valeurs du temps de relaxation chez des souris « sauvages ».
Questionnement
- A partir des informations extraites des documents, indiquer si elles infirment ou confirment l’efficacité contre les symptômes de la DM1 d’une thérapie génique fondée sur la production par ingénierie de protéines leurres.
- L’action de ces protéines leurres peut-elle être de longue durée ?
- Expliquez comment celles-ci améliorent le phénotype des cellules musculaires DM1.
Exploitation pédagogique
 |
Cinquième partie : Stratégies thérapeutiques |
