Une révolution clinique au cours des années 2010 : les thérapies protéiques
Une révolution clinique au cours des années 2010 :les thérapies protéiques
- Principe de la thérapie protéique
La décennie 2010-2020 est marquée par une révolution dans la thérapie de la mucoviscidose qui va améliorer les conditions de vie des patients. Il s’agit de la thérapie protéique permise par la mise au point de molécules qui agissent sur les protéines CFTR mutées. Appelées modulateurs, elles ont pour effet de corriger au moins partiellement le dysfonctionnement des protéines CFTR muées et donc de les rendre davantage fonctionnelles.
La figure ci-dessous fournit une vue d’ensemble du mécanisme d’action de ces modulateurs.
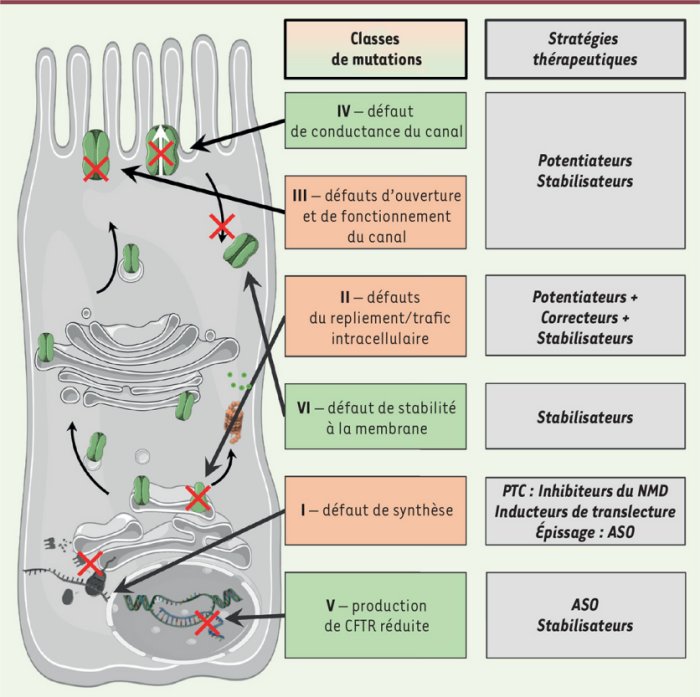
Classes de mutations entraînant la mucoviscidose et actions des modulateurs de thérapie protéique. Emmanuelle Bardin et al. Médecine sciences Mars 2024
Les parties gauche et médiane sont un rappel des connaissances acquises sur les mutations affectant le gène CFTR et leur impact sur la protéine CFTR. Les mutations de classe I, II et III entraînent des symptômes cliques sévères de la mucoviscidose. Les protéines résultant des mutations IV, V et VI ont une activité résiduelle et les patients qui les possèdent sont moins affectés. Les dysfonctionnements des protéines CFTR mutées diffèrent et leurs corrections nécessitent donc des molécules ayant des actions différentes, ciblées sur les mutations en cause. Ces molécules sont appelées modulateurs. La colonne de droite de la figure indique les principaux types de modulateurs : Potentiateurs, correcteurs, stabilisateurs.
- Thérapie protéique et mutations de classe I.
Les modulateurs ont pour fonction de restaurer au moins partiellement la fonction des protéines CFTR mutées. Avec les mutations de classe I dues globalement à un codon stop très anticipé entraînant un arrêt de la synthèse de la protéine, il n’y a pas de production de la protéine et en conséquence les modulateurs n’ont aucune action. La thérapie protéique ne peut ête proposée à ces patients (environ 10% des cas de mucoviscidose).
- Les potentiateurs
Le premier modulateur mis au point en 2012, l’Ivacaftor est un potentiateur. Il augmente la durée d’ouverture des canaux CFTR mutés dont le fonctionnement est dérégulé. Ce potentiateur
restaure au moins partiellement l’activité des protéines qui ont atteint la membrane plasmique apicale de cellules épithéliale. Ces canaux mutés ont une faible activité résiduelle et Ivacator potentialise leur activité. Cette thérapie par Ivacaftor apporte un gain de la fonction respiratoire des patients (augmentation du VEMS de l’ordre de 10% ).Ivacaftor est particulièrement approprié pour corriger les protéines CFTR dues à des mutations de classe III comme l’indique la figure.
- Les correcteurs Lumacaftor et Tezacaftor
Comme l’indique la figure ce sont des modulateurs qui corrigent les défauts de repliement des protéines CFTR mutées au cours de leur trafic intracellulaire depuis leur synthèse jusqu’à la membrane plasmique des cellules épithéliales. Elles restaurent ainsi les protéines résultant de l’expression des mutations do classe II dont la plus fréquente (70%) est Phe 508 del/ Grâce à leur action desprotéines CFTR arrivent à la membrane et forment des canaux à chlorures fonctionnels. Néanmoins les canux bien que corrigés, présentent un défaut d’ouverture. L’association de ces correcteurs avec un potentiateur comme Ivacaftor permet de stimuler l’ouverture du canal et conduit à un effet thérapeutique réel mais modéré. Cela a suscité l’intérêt pour étudier l’impact de l’association de plusieurs modulateurs.
- Les triples combinaisons
Les chercheurs ont testé l’association de deux correcteurs, Elexacaftor (ElX) et Tezacaftor (TEZ) avec le potentiateur Iva chez des patients homozygotes CFTR Phe508del et des patients ayant un seul allèle CFTR Phe508del et un allèle codant pour une protéine ayant une activité résiduelle. Dans les deux cas, cette association connue sous le nom de Kaftrio a permis des améliorations spectaculaires allant rapidement jusqu’à un gain de 14% du VEMS et des conditions de vie avec des bénéfices majeurs.
Les premiers essais cliniques ont d’abord été réalises chez des patients de plus de 12 ans. Des essais cliniques chez des enfants de 2 à 11 ans ont révélé que le traitement par Kaftrio chez eux était aussi efficace pour améliorer leur fonction respiratoire. Depuis novembre 2023, cette trithérapie protéique a donc été autorisée chez les enfants de plus de deux ans par les autorités de santé.
Des effets indésirables du Kaftrio ont cependant été observés. Les recherches visant à remplacer ELX par un autre correcteur (Vanzacaftor (VAN)) qui aurait moins d’effets indésirables sont en cours, ainsi qu’une version d’IVA qui permettrait une seule prise journalière au lieu de deux.
Un sujet (exercice 2) : mucoviscidose : mutations et traitement ayant comme support la trithérapie protéique a été proposé en France métropolitaine à la session de 2023
- Les modulateurs stabilisateurs
La figure montre que les mutations de classes IV à VI peuvent être corrigées par des modulateurs appelés stabilisateurs. Ceux-ci visent à stabiliser les protéines à la surface des cellules épithéliales. Ils peuvent aussi avoir une efficacité pour les protéines corrigées par d’autres modulateurs. L’objectif pour ces stabilisateurs est de réduire l’endocytose des protéines CFTR et ainsi d’augmenter la quantité de canaux disponibles à la membrane plasmique.
- Les limites de la thérapie protéique
La première limite réside dans le fait que l’ensemble des thérapies protéiques n’est pas efficace sur tous les cas de mucoviscidose. Elles sont sans effet chez les patients porteurs de mutations de classe I, mutations caractérisées par un codon stop anticipé précoce conduisant à des protéines CFTR raccourcies, très rapidement dégradées. Cela représente environ 10% des cas de mucoviscidose.
La deuxième limite est due au fait que le traitement par les thérapies protéiques n’assure pas la guérison. Puisqu’elles n’agissent pas sur le gène CFTR muté, celui-ci reste toujours présent dans les cellules. Dans un article de 2018 paru dans le « Journal of cystic fibrosis », deux cliniciens (A.Trimble et S. Donaldson) font part de constats faits chez deux patients ayant dû interrompre leur traitement par Ivacaftor. Ces deux patients sont porteurs de la mutation G551D qui est une mutation de classe III donc qui affecte l’ouverture du canal CFTR à la membrane. La figure ci-dessous en illustre les conséquences, notamment sur la fonction respiratoire des patients.
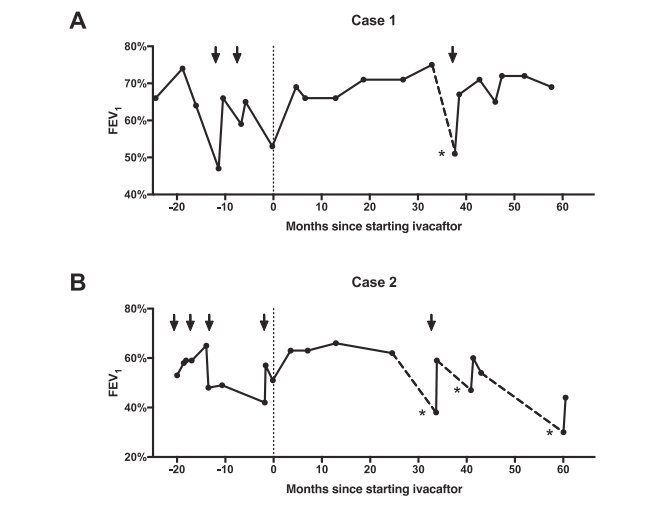
Evolution de la fonction pulmonaire
En ordonnée, FEV « forced expiratory volume in an second " est équivalent à VEMS (volume maximum d’air qu’une personne peut expirer en une seconde. Ce VEMS des patients est exprimé en pourcentage du VEMS d’une personne en bonne santé . Durant la période étudiée, les patients ont été victimes de moments d’exacerbations des symptômes pulmonaires traités par des antibiotiques, ce qui est indiqué par des flèches. La fonction pulmonaire a été évaluée à partir d’une période commençant 24 mois avant le début du traitement par Ivacaftor (qui est indiqué par un repère en pointillé). Les moments d’arrêt d’Ivacaftor sont indiqués par un astérisque et l’évolution de la fonction pulmonaire durant cette période est visualisée par une ligne en pointillés.
A fonction pulmonaire du premier cas. B : fonction pulmonaire du deuxième cas.
Le premier patient est un homme de 25 ans possédant le génotype G551D/F508del. Il a été traité avec une bonne réponse par Ivacaftor (VEMS de 75%). Cela indique une restauration de l’activité de la protéine CFTR codée par l’allèle G551D. Le phénotype du patient est alors proche de celui d’une personne hétérozygote possédant un allèle Phe508del. Suite à un arrêt de disponibilité de Ivacaftor, la prise de ce médicament a été interrompue. Les autres traitements symptomatiques ont été maintenus. Trois jours après l’arrêt , le patient a éprouvé des difficultés à respirer, une toux grasse , des douleurs dans la poitrine et de la fièvre. Un traitement avec des antibiotiques a été entrepris. Le VEMS du patient est tombé à 51% . Le traitement par Ivocaftor a été repris et un mois plus tard, son VEMS était de 67%.
Le second patient est un homme de 27 ans avec le même génotype que le premier. Il a été aussi traité par Ivocaftor avec une bonne réponse. Trente trois mois après le début de la thérapie avec Ivacaftor, il y a eu une interruption dans la prise de ce médicament. Dans les 3 jours qui ont suivi, le patient a souffert de dypsnée, d’une toux grave et finalement les mêmes symptômes que le premier patient. Son VEMS qui était de 62% a chuté à 38%. Il a été hospitalisé et sa thérapie avec Ivacaftor a été reprise. En 5 jours ses symptômes se sont améliorés et son VEMS est remonté à 59%. Le patient a cessé de prendre Ivacaftor 7 mois plus tard. Durant les 5 jours qui ont suivi, les symptômes pulmonaires se sont exacerbés et il a été hospitalisé. Son VEMS était alors de 47%. La thérapie avec Ivacaftor a été réinitialisée et 14 jours plus tard son VEMS était de 60%. Le patient a interrompu son traitement avec Ivacaftor 17 mois plus tard. Ses stmptômes respiratoires se sont à nouveau aggravés et son VEMS a baissé jusqu’à 30%. Un traitement avec des antibiotiques et une reprise de Ivacaftor ont permis une amélioration nette des symptômes respiratoires et une augmentation de son VEMS jusqu’à 44%.
Les thérapies protéiques sont des traitements symptômatiques qui nécessitent une administration à vie et dont on ignore encore les effets secondaires à long terme. Néanmoins ils ont permis une amélioration très importante de la qualité de vie des patients traités et des améliorations de ces molécules sont en cours.
