Des essais cliniques multiples
Des essais cliniques multiples .
1 - Les transgènes conçus
Généthon n’est pas le seul organisme ayant conçu un produit de thérapie génique de la DMD. Sarepta therapeutics, Pfizer et Solid Biosciences ont conçu leur propre gène thérapeutique codant aussi pour une microdystrophine et entrepris après autorisation, des essais cliniques. La figure ci-dessous renseigne sur les caractéristiques du gène DMD de ces organismes.
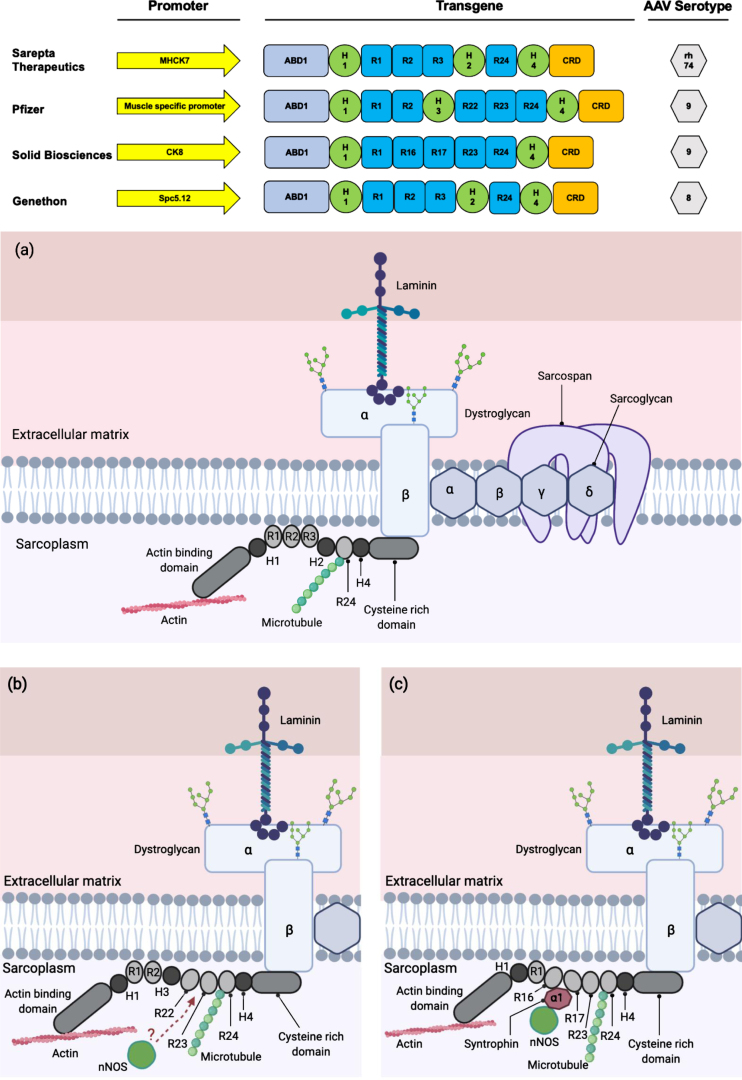
En haut, schémas de la structure du transgène de ces organismes. Pour les quatre, il y a un promoteur (en jaune) spécifique pour les muscles et le coeur et activant l’expression du transgène dans ces tissus.
Les domaines du transgène sont indiqués : en violet, le domaine de liaison à l’actine (ABD1) ; en bleu foncé, les répétitions R du domaine central avec indications des R conservés ; en orange le domaine riche en cystéine (CRD) qui se lie au complexe de protéines membranaires ; en vert les charnières.
En a,b,c les structures des microdystrophines respectives de Généthon et Sarepta therapeutics, de Pfizer, et de Solid biosciences sont illustrées. Généthon et Sarepta ont conçu un transgène semblable de sorte que ces deux organismes ont décidé de collaborer dans leurs essais cliniques.
Source: Nertiyan Elangkovan and George Dickson. Gene Therapy for Duchenne Muscular Dystrophy. J Neuromuscul Dis. 2021.
2 - Comparaison des trois transgènes
Fichier pour Anagène : Séquences thérapeutiques.edi

DMD vs Généthon

DMD vs Pfizer

DMD vs Solid biosciences
Représentation graphique (DotPlot) des séquences des transgènes comparés à la protéine DMD complète.
Les trois transgènes montrent une réduction importante du nombre de « repeats » (R) du domaine central « rod » ; ils ne possèdent pas aussi la séquence du domaine terminal. Il en résulte une diminution importante du nombre de nucléotides de ces transgènes par rapport au gène DMD complet ce qui permet leur incorporation dans un vecteur AAV. Les trois transgènes codent donc pour une dystrophine considérablement réduite, une microdystrophine. Les transgènes possèdent le domaine ABD1 qui assure la liaison avec l’actine du cytosquelette et le domaine CRD qui se connecte avec les protéines transmembranaires dystroglycanes. Ainsi, comme l’illustre la figure, les trois microdystrophines sont normalement situées sous la membrane plasmique et assurent une liaison entre l’actine du cytosquelette et la matrice extracellulaire.
Les trois transgènes diffèrent par le nombre et surtout la nature des « R » retenus dans le transgène. Ainsi, contrairement au transgène de Généthon, celui ne Pfizer ne possède pas R3 et celui de Solid Biosciences ni R2, ni R3. En revanche, le transgène de Bioscience possède R16 et R17, et celui de Pfizer R22 et R23. Ces choix résultent d’une réflexion sur le rôle de ces séquences dans les cellules musculaires.
3 - Un autre produit de thérapie génique de la DMD, RGX-202
En 2023, le laboratoire américain Regenxbio a développé un produit de thérapie génique nommé RGX-002. Administré à des souris mdx, modèle de la DMD humaine, le produit a permis la production de microdystrophine dans le muscle. Fort de cette « preuve » et des autorisations requises, Regenxbio a démarré un essai clinique aux Etats-Unis.
La figure ci-dessous renseigne sur la structure du transgène et sur celle de la microdystrophine produite.
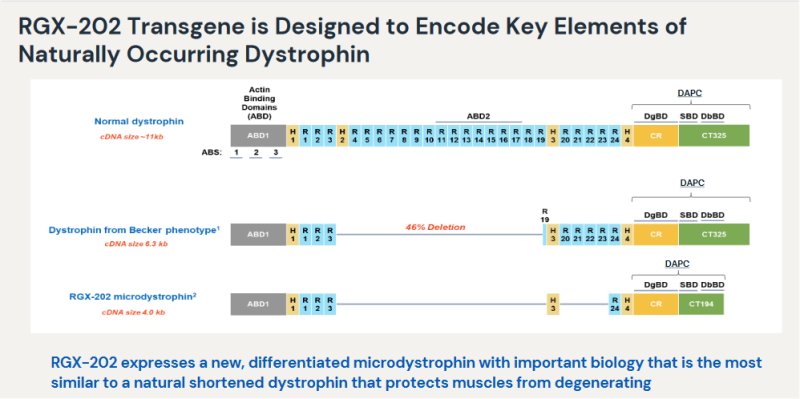
Le document renseigne sur les domaines du transgène RGX-202 par rapport à ceux du gène DMD complet et du gène codant pour une dystrophine cause d’une myopathie de Becker. La mention 46% de délétion indique que l’allèle choisi pour cette myopathie de Becker est celui précédemment étudié (myopathie très peu sévère).
Avec cette représentation, les chercheurs veulent visualiser la similitude entre les séquences du gène à l’origine d’une DMD et celle du gène RGX-202 qu’ils ont conçu pour leur thérapie génique. A la délétion du domaine central « rod » du gène « DMD » qui va des « repeats » R4 à R19 compris, correspond dans RGX-202 l’absence des « repeats » R4 à R23. Par contre, comme le gène DMD, RGX-202 possède les séquences qui codent pour le domaine ABD de liaison à l’actine et les domaines CRD (domaine riche en cystéine) et CT (domaine terminal) qui assurent la liaison de la dystrophine avec le complexe de protéines membranaires et cytoplasmiques (DAPC). Toutefois le domaine terminal présent dans RGX-202 est plus court (194 nucléotides au lieu de 325) mais la séquence retenue est celle qui assure la liaison avec les protéines (voir structure de la dystrophine) dystrobrevine et syntrophine. Ainsi, les chercheurs de Regenxbio mentionnent que leur gène RGX-202 code pour tous les domaines clés de la dystrophine. Ils disent que leur gène exprime une nouvelle microdystrophine la plus semblable à celle exprimée naturellement par le gène DMD en cause dans la myopathie de Becker très peu sévère. Le gène RGX-202 est suffisamment raccourci pour être intégré dans un vecteur rAAV.
Ils insistent sur le fait que leur gène est le seul à coder une microdystrophine avec les éléments fonctionnels du domaine terminal, sous entendu cela signifie que leur microdystrophine doit être plus performante. On voit là la concurrence entre les équipes qui travaillent sur le même objectif thérapeutique en faveur des patients. Les résultats des essais cliniques tant en ce qui concerne la sécurité et l’efficacité permettront peut-être dans quelques années de proposer un ou plusieurs produits performants pour guérir les patients DMD.
