Le vecteur viral utilisé dans cette thérapie
I - Le vecteur viral utilisé dans cette thérapie
A - Une thérapie génique in vivo
Le produit GNT004 injecté dans la circulation sanguine d’un jeune patient DMD au cours de cet essai, associe un vecteur viral AAV et une version de la séquence du gène DMD qui code pour une dystrophine fonctionnelle (gène thérapeutique ou transgène) mise au point par les chercheurs. Un très grand nombre de ces vecteurs sont injectés de sorte qu’on attend qu’un certain nombre d’entre eux pénètrent dans les cellules musculaires squelettiques et cardiaques et transfèrent ainsi à ces cellules le transgène thérapeutique. C’est un exemple de thérapie génique in vivo, donc différent de la thérapie génique ex vivo du DICS-X et de la drépanocytose. C’est aussi une thérapie par addition d’un gène thérapeutique aux cellules malades et non par édition du génome.
B - Virus AAV et vecteur rAAV
1. Les virus AAV
Le vecteur viral utilisé dans cette thérapie est dérivé des virus AAV (Adeno-Associated Virus - Virus Adéno associé).
Les virus AAV sont de petits virus de 20 à 25 nanomètres de diamètre qui peuvent infecter plusieurs types de cellules humaines mais sans causer de maladie : ils sont non pathogènes. Contrairement aux rétrovirus, ils ne sont pas enveloppés. Ils possèdent une capside protéique formée par l’association de 3 types de protéines. A l’intérieur de la capside se trouve leur génome constitué par une molécules d’ADN à un seul brin de 4,7 kb. Ce génome possède deux gènes Rep et Cap codant pour 4 et 3 sortes de protéines respectivement. Le gène Cap code pour les protéines de la capside et le gène Rep pour des protéines intervenant dans la réplication du virus. Aux deux extrémités du génome se trouve une séquence ITR non codante mais qui joue un rôle dans la réplication et l’expression des gènes.
Les virus AAV possèdent une variabilité au niveau des protéines de la capside qui fait qu’on reconnaît plusieurs souches (Exemples : AAV2, AAV8, AAV9...). Ces différences font que les souches du virus ont un tropisme variable suivant le type cellulaire. Les souches AAV8 et AAV9 ont une forte affinité pour les cellules musculaires.
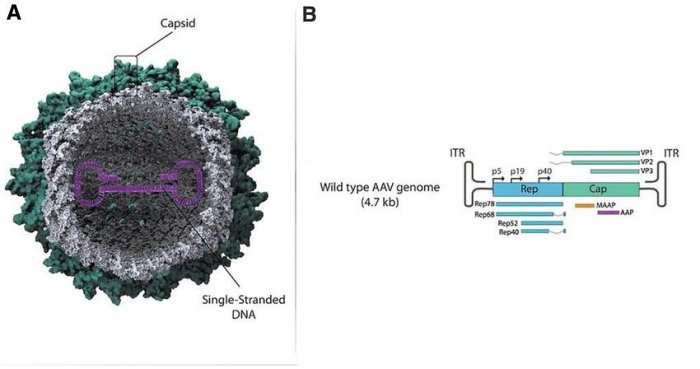
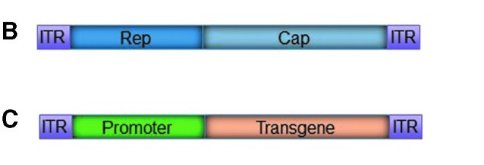
Figure 1 - Schématisations de la structure d’un virus AAV et de son génome.
Source : Current Update on Severe Acute Respiratory Syndrome Coronavirus 2 Vaccine Development with a Special Emphasis on Gene Therapy Viral Vector Design and Construction for Vaccination. Human genetics. 2021
2. Les vecteurs rAAV
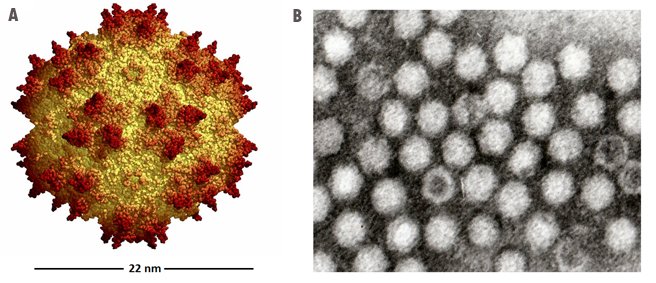
Figure 2 - Génomes d’un virus AAV et d’un vecteur rAAV. La figure A est une représentation externe d'un vecteur utilisé en thérapie génique de la DMD. la figure B est une observation en microscopie électronique de vecteurs viraux purifiés tels qu'ils existent dans le produit GNT0004.
Source : Michael E. Nance and Dongsheng Duan. Perspective on Adeno-Associated Virus Capsid Modification for Duchenne Muscular Dystrophy Gene Therapy. Hum Gene Ther. 2015
Le vecteur rAAV qui dérive d’un virus AAV en possède la même structure globale : à l’intérieur de la capside se trouve le génome. Les structures de la capside ainsi que les protéines qui la constituent sont les mêmes. Ce qui fait fondamentalement la différence entre le vecteur et le virus est le génome. Le génome du vecteur ne possède pas les gènes Rep et Cap ; à la place il possède le gène thérapeutique et son promoteur, c’est-à-dire le gène codant pour une dystrophine fonctionnelle. Les seuls éléments du génome du virus présents dans le génome du vecteur sont les séquences ITR. Celles-ci sont indispensables à l’expression du gène thérapeutique.
3. Comportement du vecteur dans la cellule qu’il transducte
Les vecteurs injectés dans la circulation sanguine au cours de la thérapie génique du Généthon présentent un fort tropisme pour les cellules musculaires squelettiques et cardiaques. Cela signifie que des éléments de la capside se lient avec efficacité à des récepteurs de la membrane de ces cellules. Cela entraîne l’incorporation du vecteur dans la cellule. De là, le vecteur est véhiculé jusqu’à un noyau. La capside est alors éliminée et le génome du vecteur est donc libre dans le noyau. Contrairement à ce qui se passe pour les rétrovirus, le génome vectoriel n’est pas intégré dans le génome de la cellule (on qualifie le vecteur de non intégratif). On dit qu’il persiste sous forme d’épisome mais le fait important est que son gène thérapeutique s’exprime, produisant ainsi une dystrophine thérapeutique dans les cellules musculaires. Ce comportement est illustré dans la figure 4.
Deux points importants méritent d’être soulignés.
- Le premier est que, puisqu’il ne s’intègre pas dans le génome cellulaire, le génome du vecteur ne risque pas d’activer un proto oncogène comme cela peut arriver avec un vecteur rétroviral. La sécurité du vecteur rAAV est un des atouts qui fait que ce type de vecteur est considéré comme un outil de choix pour la thérapie génique.
- Le deuxième point résulte des observations faites sur des modèles animaux. En particulier, certains chiens Golden retriever développent naturellement la myopathie de Duchenne. Les essais de thérapie génique réalisés sur ces chiens ont montré que le gène thérapeutique persistait et s’exprimait dans les cellules musculaires pendant plusieurs années. Cela présente l’intérêt de ne pas avoir à renouveler l’injection de vecteurs fréquemment.
4. Réactions immunitaires vis-à-vis des virus AAV et des vecteurs rAAV
Les virus AAV ne sont pas pathogènes. Cependant, les populations humaine sont exposées à ces virus et de nombreuses personnes sont parasitées. Chez elles, des réactions immunitaires contre les protéines de la capside ont produit des anticorps neutralisants. Si un patient DMD possède des anticorps anti-AAV spécifiques de la même souche que celle du vecteur (par exemple AAV9), le produit injecté sera inefficace. Dans ce cas, on ne peut proposer ce type de thérapie au patient.
En dehors d’une immunisation préalable, les protéines de la capside du vecteur injecté peuvent déclencher une réaction immunitaire. Ce qui ne permettra pas une « réadministration » qui pourrait s’avérer nécessaire en cas d’épuisement de l’effet du transgène thérapeutique au-delà d’un délai encore difficile à prédire, peut-être de 8 à 10 ans.
Les progrès dans l’utilisation des AAV dans les thérapies géniques ont consisté à sélectionner les souches les plus efficaces pour transférer le gène thérapeutique aux cellules cibles et à limiter au maximum les réactions immunitaires.
La figure ci-dessous illustre de façon exhaustive les réactions immunitaires innées et adaptatives, théoriquement possibles, liées à l’entrée d’un vecteur rAAV dans une cellule. Les caractéristiques du vecteur sélectionné limitent ces réactions, ce qui permet d’assurer l’efficacité et la sûreté de la thérapie.
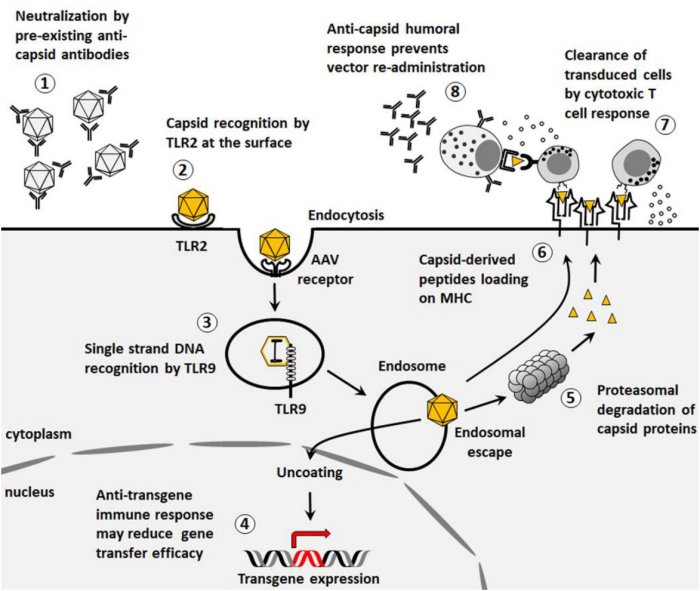
Figure 3 - Les réactions immunitaires.
Source : Giuseppe Ronzitti, David-Alexandre Gross, and Federico Mingozzi. Human Immune Responses to Adeno-Associated Virus (AAV) Vectors. Front Immunol. 2020.
La figure schématise aussi (et surtout) le comportement du vecteur qui permet d’aboutir à l’objectif visé : produire de la dystrophine fonctionnelle dans le cas d’une cellule musculaire.
