Un aperçu de l’épigénétique
Analyse par Jean-Claude Hervé (Ex IA-IPR de l'Académie de Versailles)
Résumé
- L'épigénétique se rapporte à des mécanismes qui :
- modifient l'expression des gènes sans changement de leurs séquences d'ADN en agissant au niveau des séquences régulatrices ;
- interviennent au cours du développement embryonnaire ;
- sont à l'origine des différentiations cellulaires.
- Les marques épigénétiques peuvent être modifiées par des facteurs de l'environnement, les épimutations, qui sont héritables mitotiquement. De cette façon, l'environnement peut agir sur les phénotypes des organismes et être parfois à l'origine de pathologies.
- Les mécanismes épigénétiques sont variés et touchent aussi bien l'ADN que les histones qui y sont associés et à travers eux au degré de condensation de la chromatine :
- la méthylation de cytosines appartenant à des dinucléotides CpG est la seule marque épigénétique de l'ADN ; elle inhibe l'expression du gène ;
- les marques épigénétiques des histones sont plus variées : méthylation, acéthylation, phosphorylation, etc. ; certaines stimulent l'expression des gènes, d'autres la bloquent.
- Les marques épigénétiques acquises au cours du développement sont héritables mitotiquement (mémoire cellulaire).
- Les marques épigénétiques sont réversibles (exemple : la reprogrammation des cellules différenciées).
Introduction
En 2012 a été créée au Collège de France la chaire « Epigénétique et mémoire cellulaire » qui a été confiée à Edith Heard. Dans sa leçon inaugurale, celle-ci précise qu’il s’agit d’un champ d’investigation nouveau et très riche de la biologie, qui touche aussi bien le développement des organismes et les variations normales ou pathologiques de celui-ci, notamment en lien avec l’environnement, que l’hérédité et l’évolution.
Les revues de vulgarisation scientifique mais aussi les médias se sont emparés du sujet et la littérature dans ce domaine est abondante avec des titres accrocheurs. Ainsi, La Recherche en avril 2012, a conçu un dossier : « L’hérédité au-delà des gènes ». Dans une de ses pages scientifiques, le journal Le Monde publie en avril 2012 un article : « L’épigénétique, l’hérédité au-delà de l’ADN ». Reprenant le titre d’un petit livre d’Andràs Pàldi publié aux Editions Le Pommier en 2009, la revue Pour la science a édité fin 2013 un dossier intitulé « L’hérédité sans gènes », avec comme sous-titre « Comment l’environnement rabat les cartes ».
A lire ces titres, on a l’impression que l’épigénétique s’oppose à la génétique, qu’il s’agit d’une remise en cause de la génétique classique. En réalité, à une époque où les génomes de nombreux organismes et en premier lieu de l’Homme ont été séquencés, où les techniques d’identification d’un individu à partir de son ADN ont une précision et une fiabilité remarquables, l’épigénétique module cette perspective d’un déterminisme génétique pur et dur du devenir d’un individu. Ainsi, le généticien Jonathan Weitzman, dans une video d’une quinzaine de minutes sur Canal–U, pose la question : « Qui suis-je entre génétique et épigénétique ? ».
Pour mieux saisir, la nature de l’épigénétique, il est bon de faire un résumé de l’historique de ce nouveau domaine de la biologie.
Bref historique de l'épigénétique
Origine du terme
Le terme a été créé en 1942 par Conrad Waddington, donc à une époque où on n’avait pas encore établi la nature ADN du support de l’information génétique contenue dans les chromosomes. Dans ce terme épigénétique, on trouve le terme épigénèse, qui est en rapport avec le développement des organismes.
Historiquement, deux grandes conceptions du développement se sont opposées :
- Selon l’une, l’organisme en miniature est préformé dans l’œuf ;
- Selon l’autre, appelée épigénèse, l’organisme se construit progressivement au cours du développement embryonnaire à partir de l’œuf où aucune structure n’existe.
L’épigénèse s’est imposée aux 18ème et 19ème siècle. Waddington veut rapprocher la génétique telle qu’elle résulte des travaux de Mendel et de la théorie chromosomique de l’hérédité, de l’épigénèse. Jusque-là la génétique visait surtout à faire un inventaire des gènes et de leur position sur les chromosomes.
Pour Waddington, l’important est de comprendre comment les gènes au cours du développement contribuent à la réalisation progressive d’un organisme ayant une organisation bien définie, autrement dit comment les gènes déterminent le phénotype d’un organisme. Pour définir cette nouvelle perspective il crée le terme d’épigénétique. Waddington propose des explications théoriques sur les mécanismes en jeu, imaginant que le développement embryonnaire mobilise des réseaux changeants d’interactions entre gènes.
La naissance de la biologie moléculaire
La mise en évidence que l’ADN est le support de l’information génétique, la découverte de sa structure par Watson et Crick en 1953 , l’établissement des mécanismes de l’expression des gènes, débouchant sur le dogme de la biologie moléculaire et le code génétique, fournissent la base de la compréhension de la manière dont le génotype détermine le phénotype. Cependant, ce principe fondamental ne suffit pas pour expliquer les modalités de l’intervention des gènes dans la réalisation du phénotype global de l’organisme au cours du développement.
La régulation de l’expression des gènes
Les expériences de transplantation nucléaire de Briggs et King en 1952, et surtout de Gurdon en 1962, apportent la preuve expérimentale que toute l’information génétique présente dans le zygote se retrouve dans toutes les cellules différenciées de l’organisme. Les différences entre les phénotypes cellulaires ne peuvent s’expliquer que par des différences dans l’expression des gènes suivant les types cellulaires. Cela implique des mécanismes de régulation de l’expression des gènes.
En 1962, Monod et Jacob établissent les principes de cette régulation chez les procaryotes, élaborant ainsi la notion de promoteur et de séquence régulatrice, et montrant comment un facteur d’environnement, le lactose, pouvait agir sur l’expression d’un gène, celui de la lactase.
Durant les années suivantes, les chercheurs ont élucidé les mécanismes de régulation de l’expression des gènes chez les eucaryotes. Ainsi, on a établi l’existence de gènes de régulation qui codent pour des protéines, les facteurs de transcription, qui, en se liant aux régions régulatrices de l’expression de gènes cibles, en régulent l’expression en l’activant ou la réprimant.
La génétique du développement connaît un essor considérable à partir des années 1980 avec, notamment, la découverte des gènes homéotiques. La réalisation du phénotype au cours du développement semble résulter de l’action des processus de régulation qui contrôlent l’intensité, les territoires et le moment d’expression de ces gènes. On retrouve l’idée des réseaux changeants d’interaction entre gènes de Waddington mais cette fois à partir de données moléculaires précises.
L’épigénétique et l’expression des gènes
La méthylation de l'ADN et l'expression des gènes
Une révolution conceptuelle durant les années 70 et 80 a eu lieu, révolution dans la mesure où on a pris conscience que les mécanismes de régulation évoqués précédemment ne suffisaient pas pour rendre compte de ce qui se passait au cours du développement. Cette révolution s’appuie sur les données expérimentales relatives à l’hérédité mitotique des états différenciés des cellules. Des cellules différenciées en culture engendrent des cellules présentant la même différenciation. Les cellules basales de l’épiderme, en se divisant, engendrent toujours des cellules où les gènes de la kératine s’expriment, alors que d’autres gènes sont toujours inactifs. Les cellules filles héritent non seulement de la totalité des gènes de la cellule maternelle mais aussi de leur état d’activité. Cette stabilité de l’expression génétique au cours des divisions cellulaires, pose un problème fondamental : comment cette information sur l'activité des gènes est-elle donc transmise ?
Durant les années 50, peu de temps après la découverte de la structure de l’ADN, on a constaté que cette molécule présentait des modifications au niveau de certaines de ses bases qu’on a appelées méthylation. Il s’agit d’un branchement d’un radical méthyle CH3 sur la cytosine d’un nucléotide à cytosine. Plus précisément, cette méthylation n’a lieu que si le nucléotide à cytosine est suivi d’un nucléotide à guanine : on parle de dinucléotide CpG (p pour phosphate).
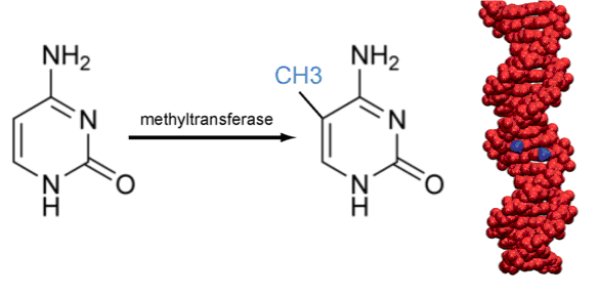

Pendant une vingtaine d’années la signification de cette méthylation est restée inconnue. En 1975, deux chercheurs, Holliday et Riggs, font l’hypothèse que cette méthylation influence l’expression des gènes, plus exactement l’inhibe et qu’elle est transmise au cours des divisions cellulaires.

Méthylation et expression des gènes. GENE = région transcrite. Le rectangle à gauche correspond à l'ensemble séquence régulatrice (enhancer) et promotrice. Les cercles grisés ou non représentent les sites CpG.
Comme la réplication de l’ADN est semi conservative, cela suppose que le brin d’ADN néoformé est méthylé après sa formation comme illustré ci-dessous.

Cela suppose l’existence d’enzymes, les méthyltransférases, qui catalysent la méthylation des cytosines. Ces enzymes ont été découvertes par la suite et on a montré que leur inactivation causait un développement anormal de l’organisme et était finalement létale. Ainsi, la méthylation ou non de l’ADN apparaît comme un marqueur de l’état d’activation d’un gène transmissible au cours de la division cellulaire. Cela a conduit à donner un nouveau sens à l’épigénétique. En 1994, Holliday propose de définir l’épigénétique comme l’étude des changements d’expression des gènes transmissibles au travers des divisions cellulaires sans changement de la séquence de l’ADN.
La méthylation de l’ADN est donc une marque épigénétique. Cette méthylation d’un gène est fonction de la richesse de sa séquence en dinucléotides CpG. On a montré que la méthylation de la séquence codante d'un gène n’a pas d’effet sur son expression. C’est la méthylation de la région promotrice et des régions régulatrices qui affectent l’expression du gène.
Par la suite, on utilisera l'expression région régulatrice pour désigner cet ensemble.
Une diversité des processus épigénétiques
Depuis une quinzaine d’années, les recherches dans le domaine de l’épigénétique se sont multipliées et on a découvert que les marques épigénétiques sont plus diverses que la seule méthylation de l’ADN. Il s’agit par exemple des diverses modifications des histones, protéines associées à l’ADN dans la chromatine. La méthylation des histones empêche l'expression des gènes ; l’acétylation la favorise au contraire. Ces modifications des histones comme la méthylation de l’ADN retentissent sur la structure de la chromatine (son état de condensation) et par là sur la transcription. Enfin, on a découvert récemment des ARN non codants qui régulent l’expression des gènes par des mécanismes encore mal élucidés.
Reprogrammation génétique au cours du développement
Les gamètes sont des cellules très spécialisées. La chromatine du spermatozoïde par exemple est très condensée, ce qui signifie que les gènes de cette cellule, dans leur très grande majorité, ne sont pas transcrits. Les marques épigénétiques sont nombreuses dans le zygote. Dans un premier temps, le zygote et les premiers blastomères formés font table rase de ces marques épigénétiques. Par exemple, on a montré que sous l’action de facteurs (protéines, ARNm) présents dans le cytoplasme de l’ovocyte et donc du zygote, il y a une déméthylation presque totale du génome paternel et du génome maternel (mais des modifications intéressant les protéines chromatiniennes ont aussi lieu).

Déméthylation et développement embryonnaire préimplantatoire. Noter au stade Blastocyste la couche cellulaire externe et le massif des cellules internes (bouton embryonnaire).
Le zygote commence ensuite à se multiplier. Jusqu’au stade 4 chez la souris, les blastomères sont totipotents c’est à dire capables isolément d’engendrer un organisme complet. A partir du stade 16 cellules, une première différenciation s’effectue avec l’individualisation d’une couche cellulaire externe, le trophoblaste qui donnera par la suite les tissus extra embryonnaires, notamment le placenta et une masse cellulaire interne, le bouton embryonnaire à l’origine de l’embryon proprement dit
Cette première différenciation résulte de l’expression du génome de l’embryon. La position externe des cellules du trophoblaste est un signal qui entraîne l’expression de certains gènes : il y a un profil d’expression caractéristique de ces cellules, profil qui est stabilisé par des marques épigénétiques. Le destin de ces cellules est alors fixé. Dans la masse cellulaire interne, un réseau d’autres gènes dits de pluripotence, est activé et les facteurs de transcription résultant de l’expression de ces gènes sont à l’origine d’une propriété des cellules du bouton embryonnaire, leur pluripotence. Extraites du blastocyste, ce sont des cellules souches embryonnaires (cellules ES) qui, dans un milieu de culture approprié, peuvent se multiplier indéfiniment (cellules immortelles). En modifiant la composition du milieu de culture par des facteurs adéquats, on peut les amener à se différencier dans n’importe quel type de cellule. Très récemment, en faisant des cultures en trois dimensions, on a pu obtenir in vitro des miniorganes (mini reins, mini rétine, etc.). Cela montre une caractéristique fondamentale de ces cellules, la capacité de réponse à des signaux extérieurs par une expression différentielle de leurs gènes.
In vivo, dans les cellules de la masse interne, les facteurs de transcription résultant de l’expression des gènes de pluripotence répriment l’expression des gènes de différenciation. Mais cet état de pluripotence est fugace et quand le blastocyste s’implante dans la paroi utérine, les cellules du bouton embryonnaire s’engagent dans des voies de différenciation. Le principe général est le suivant : en fonction du contexte où se trouve placée une cellule, de ses interactions avec les autres cellules, des signaux chimiques extracellulaires reçus, des gènes sont activés qui codent pour des facteurs de transcription. Ces derniers vont activer certains gènes et en réprimer d’autres et par là engager la cellule dans une voie de différenciation. Cette réponse transcriptionnelle est ensuite consolidée par des modifications épigénétiques. Ces modifications épigénétiques assurent la stabilité du destin cellulaire et la perpétuation de cette identité aux cellules filles issues de la cellule d’origine. Sans ce verrou les orientations développementales seraient labiles et la constitution de tissus homogènes impossible. Cette stabilité et cette hérédité cellulaire font que le génome est diversifié en de multiples épigénomes auxquels sont associés des programmes de transcription et des identités cellulaires divers.
La reprogrammation des cellules somatiques
Le clonage
Dans les expériences de clonage par transfert nucléaire, un noyau de cellule somatique spécialisée est introduit dans le cytoplasme d’un ovocyte énucléé. Ce noyau a des marques épigénétiques qui correspondent à l’épigénome de la cellule différenciée. Sous l’action des facteurs (protéines, ARNm, etc.) présents dans le cytoplasme de l’ovocyte, il va y avoir une disparition des marques épigénétiques du noyau, élimination similaire à celle qui a lieu normalement dans un zygote. Cependant l’épigénome du noyau extrait de la cellule somatique est différent de celui des gamètes et cette table rase des marques épigénétiques du noyau est souvent imparfaite de sorte que l’efficacité du clonage par transfert nucléaire est très faible.
La production de cellules pluripotentes induites.
En 2007, Yamanaka (prix Nobel de médecine 2012) rédige un article expliquant comment il a réussi in vitro à transformer des cellules différenciées en cellules pluripotentes. Celles-ci ont globalement les propriétés des cellules souches embryonnaires, notamment celles de proliférer de façon continue (immortalité) et de se différencier en n’importe quel type cellulaire en fonction des caractéristiques du milieu de culture. Cela implique une reprogrammation génétique du noyau de la cellule différenciée pour le faire revenir à l’état pluripotent. Pour cela, Yamanaka a transfecté la cellule différenciée (par exemple un fibroblaste, cellule de la peau) avec 4 gènes responsables de l’état de pluripotence au cours du développement embryonnaire. Sous l’action des facteurs de transcription codés par ces gènes, il y a une répression des gènes s'exprimant spécifiquement dans la cellule spécialisée associée à un marquage épigénétique de ces gènes (notamment une méthylation de leurs régions régulatrices). En outre, il y a une modification des marques épigénétiques des gènes de pluripotence (notamment une déméthylation) de la cellule spécialisée qui redeviennent actifs. Ces cellules ainsi reprogrammées sont appelées cellules pluripotentes induites (IPS). Depuis 2007, des centaines de lignées de cellules IPS ont été obtenues à partir de presque tous les types de cellules adultes, et elles représentent un domaine de recherche très actif, notamment à cause des potentialités thérapeutiques (médecine régénérative).
L’épigénétique et l’environnement
L’épigénétique modifie aussi la perception de la façon dont l’environnement interagit avec le génome pour déterminer le phénotype d’un organisme.
Un exemple quasi caricatural est celui de l’abeille. On sait que la larve d’abeille qui reçoit de la gelée royale acquiert un phénotype de reine, alors que sans gelée royale elle devient une ouvrière stérile et bien différente de la reine.

Un facteur d’environnement alimentaire agit donc sur la réalisation du phénotype, ce qui suppose qu’au cours du développement ce ne sont pas les mêmes gènes qui s’expriment dans les deux cas. On a montré que cela était dû à des mécanismes épigénétiques : le blocage de la synthèse de l’enzyme ADN méthyltransférase chez des larves nourries sans gelée royale, les fait se développer en reines. Autrement dit le blocage de la méthylation de l’ADN réalisée par cette enzyme modifie le développement phénotypique.
Il semble bien aussi que des facteurs d’environnement sont à l’origine de pathologies en imprimant des marques épigénétiques sur nos gènes. Les recherches sur l’implication de l’épigénétique dans le cancer se multiplient. On a ainsi pris conscience que des facteurs d’environnement, notamment alimentaires, agissant précocement, notamment durant la période fœtale, peuvent perturber les marques épigénétiques de notre génome. Comme ces marques épigénétiques sont héritables (hérédité mitotique), elles persistent chez l’adulte même si les facteurs qui en sont à l’origine ont disparu. Elles peuvent contribuer à l’apparition de pathologies. Cela semble être le cas dans le diabète de type 2.
Des sujets en débat
Une grande question qui reste non résolue aujourd’hui est celle de la transmission d’une génération à une autre (et sur plusieurs générations) des états épigénétiques, notamment ceux acquis sous l’action de l’environnement, ce qui implique une hérédité épigénétique méiotique. Chez les mammifères, malgré quelques données en faveur de cette transmission, cela ne semble pas être le cas. D’ailleurs, chez les mammifères, il y a une reprogrammation du patrimoine épigénétique dans le zygote à chaque génération et ainsi toute épimutation acquise serait éliminée. En revanche, chez les plantes, cette hérédité épigénétique a été démontrée.
Une autre question qui prolonge d’ailleurs la précédente est celle de l’importance des processus épigénétiques dans l’évolution. Des modifications épigénétiques acquises sous l’action de l’environnement peuvent-elles avoir un impact évolutif ? Chez les mammifères cela ne semble pas le cas mais chez d’autres organismes notamment les plantes, on s’interroge pour savoir si les états épigénétiques sont transmis sur un nombre suffisant de générations pour donner prise à la sélection naturelle.
Epigénétique et génétique ne s’opposent pas
Pour qu’il y ait épigénétique, il faut d’abord qu’il existe des gènes ! Mais l’épigénétique enrichit l’information génique : cet enrichissement ne réside pas dans un changement de la séquence codante du gène (et donc la protéine reste la même) mais dans les marques épigénétiques des régions promotrices et régulatrices qui conditionnent l’expression du gène. Au cours de la division cellulaire il y a transmission d’une information génétique sur la nature de la protéine à synthétiser et une information épigénétique sur l’expression ou non du gène et donc sur la quantité de protéine à produire. Avec la génétique classique, lorsqu’un allèle d’un gène était inactif, c'est-à-dire ne codait pas pour une protéine fonctionnelle, cela est expliqué par une mutation de la séquence codante ou d’une séquence régulatrice de ce gène. Avec l’épigénétique, cela peut être dû à une marque épigénétique. Et dans les deux cas c’est héritable (hérédité mitotique).
