Le modèle génétique explicatif de Knudson
Le modèle génétique explicatif de Knudson (1971)
C’est à partir d’un traitement statistique des données sur les divers aspects du rétinoblastome (trop complexe pour être abordé avec des élèves de lycée), que Knudson a proposé une hypothèse sur les mécanismes génétiques à l’origine du rétinoblastome. Cette hypothèse est fournie de façon incomplète dans le document suivant :
![]() Document « Origine du rétinoblastome ».
Document « Origine du rétinoblastome ».
Exploitation
Le travail de l’élève consiste alors à voir si les données sur les séquences fournies confirment l’hypothèse de Knudson et amènent à la compléter.
L’hypothèse de knudson repose sur l’idée qu’un seul gène est en jeu et que c’est le même dans les deux cas de rétinoblastome héréditaire et non héréditaire. Surtout, elle suppose que les deux allèles du gène sont mutés dans le cas d’une cellule tumorale. Le génotype d’une cellule atteinte du rétinoblastome suppose donc l’existence de deux mutations, une pour chaque allèle (d’où l’expression « Two hit hypothesis »). Selon cette hypothèse, une cellule ne peut devenir cancéreuse si un seul allèle est muté. Cela signifierait que l’allèle muté est récessif et l’allèle « normal » dominant. C’est contraire à ce que laissait penser l’analyse de l’arbre généalogique de la famille A (mais conforme aux conclusions des expériences de fusion cellulaire).
Durant les années 70 et 80 les recherches se sont poursuivies sur le rétinoblastome jusqu’à aboutir à l’isolement du gène en 1986 et son séquençage en 1987. Après, on a recherché les diverses mutations en cause. Ce sont quelques-unes de ces mutations qui ont été utilisées pour établir les génotypes de quelques individus des arbres généalogiques (Document Origine du rétinoblastome). Pour les individus atteints, on a fourni le génotype des cellules cancéreuses et celui des cellules saines.
Dans le cas du cancer héréditaire, on constate que les cellules cancéreuses ont deux allèles mutés et que les cellules saines de la personne ont un allèle muté et un allèle non muté. En outre un des allèles mutés des cellules cancéreuses est le même que celui trouvé dans les cellules saines. Cela signifie qu’un des allèles mutés a été fourni par un gamète d’un des parents, celui atteint de rétinoblastome, et que le deuxième allèle muté dans les cellules cancéreuses provient d’une mutation somatique apparue dans une cellule rétinienne.
Dans les familles avec rétinoblastome héréditaire, il se peut qu'un individu possède dans toutes ses cellules un allèle muté hérité de l'un des parents et un allèle normal (10 % des cas, non illustré dans l'arbre de la famille A) sans être atteint de rétinoblastome. C'est pourquoi on devrait parler de la transmission d'une prédisposition au rétinoblastome et non de l'hérédité du rétinoblastome. Dans 90% des cas, un tel génotype entraîne l'apparition d'un rétinoblastome. Autrement dit, la probabilité pour qu’un individu ayant dans son génotype un allèle muté et un allèle non muté ne soit pas atteint est très faible (mais non nulle). Si les cellules rétiniennes ont hérité d’un allèle muté, la probabilité pour qu’une mutation intervienne sur l’autre allèle pour une ou quelques-unes des cellules rétiniennes est donc très forte mais elle n'est pas de 100%. Les mécanismes qui font que la possession d'un allèle muté prédispose à une mutation de l'allèle normal sont variés et complexes (mutations ponctuelles comme illustré, délétion, conversion de l'allèle normal en allèle muté, etc.). C’est ce qui explique la possibilité de plusieurs tumeurs dans le cas d’un rétinoblastome héréditaire. Et dans le cas d'un rétinoblastome héréditaire, on a remarqué aussi que la fréquence d’autres cancers, notamment d’ostéosarcomes, est par la suite augmentée.
Pour le cancer sporadique, les individus atteints ont deux allèles mutés dans les cellules cancéreuses, souvent deux allèles différents. En revanche, les autres cellules du corps ont deux allèles non mutés. Cela confirme l’hypothèse de la nécessité de deux allèles mutés du gène RB dans une cellule rétinienne pour qu’un rétinoblastome se développe. Cela est beaucoup moins probable que si la cellule rétinienne a déjà hérité d’un allèle muté et qu’il suffit d’une seule autre mutation somatique pour la rendre cancéreuse.
Dans le cas de la famille C, les parents du premier individu atteint d’un rétinoblastome (III1) possèdent dans toutes leurs cellules deux allèles « normaux » du gène RB ce qui est conforme avec le fait qu’ils n’ont pas été atteints par ce type de cancer durant leur enfance. Cependant leur fils possède dans toutes ses cellules non cancéreuses un allèle muté. Cela signifie que cet allèle muté était présent dès le stade œuf. Il l’a hérité d’un des gamètes qui lui a donné naissance. Il y a donc eu une mutation germinale affectant le gène RB chez un des parents (mutation de novo). A partir de là, la prédisposition au rétinoblastome devient héréditaire dans la famille comme l’illustrent III1 et III3.
On peut en conclusion de ce travail demander aux élèves de schématiser les mécanismes en jeu dans les deux types de rétinoblastome. Les figures ci-dessous illustrent des représentations possibles.
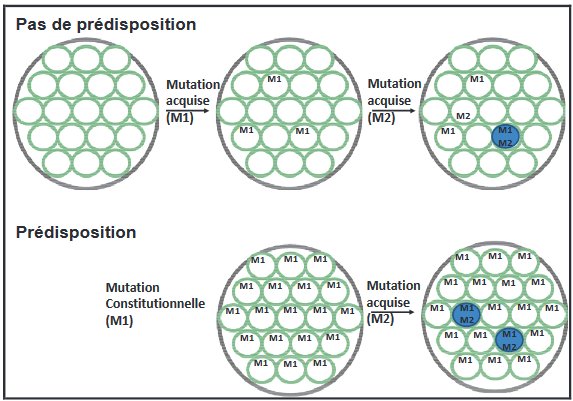
Figure 3 d'après : Etude des relations génotype phénotype dans le rétinoblastome Laurent Castera. Ici sont schématisées des rétines (grands cercles) et des cellules rétiniennes (petits cercles). Les tissus prédisposés portent la première mutation (M1) inactivant le premier allèle dans toutes les cellules. L’apparition d’une deuxième mutation (M2) inactivant le deuxième allèle d’un gène suppresseur de tumeur initie le développement d’un rétinoblastome (cercle bleu).
La figure ci-dessous résume les mécanismes causes du rétinoblastome héréditaire et non héréditaire.
.
D'après The Cell: A Molecular Approach. Geoffrey M Cooper. Boston University. Sunderland (MA): Sinauer Associates; 2000.
