4 - Les conséquences génétiques de cette anomalie chromosomique
4 - Les conséquences génétiques de cette anomalie chromosomique
![]() Document « Une conséquence génétique (moléculaire) de l’anomalie chromosomique »
Document « Une conséquence génétique (moléculaire) de l’anomalie chromosomique »
Exploitation
Le fait que cette translocation réciproque 9-22 soit quasiment présente dans toutes les cellules leucémiques des patients atteints de LMC plaide très fortement en faveur de l’idée que cette translocation est un facteur causal de la leucémie. Elle confirme aussi l’idée que les cellules leucémiques résultent d’une mutation chromosomique survenue dans une cellule souche initiale et transmise ensuite à toutes ses descendantes.
Pour confirmer cette idée il fallait découvrir les changements moléculaires dus à la translocation susceptibles de cancériser les cellules. Cela fut élucidé durant les années 80.
Le point de départ a été la mise en évidence de l’oncogène présent dans un rétrovirus (rétrovirus Abelson) provoquant une leucémie chez la souris. Les chercheurs ont ensuite trouvé l’homologue de cet oncogène viral dans le génome des cellules normales, c'est-à-dire un proto oncogène.
Dès 1982 ils ont localisé le proto oncogène ABL (symbole dérivé du virus) sur le chromosome 9 chez l’homme et précisément dans une région qui est transloquée dans les cellules leucémiques.
De même ils ont localisé sur le chromosome 22 une région appelée BCR où avait lieu la rupture préalable à la translocation du bras long du chromosome 22 sur le chromosome 9. Par la suite cette région s’est révélée correspondre à un gène qu’on a appelé BCR.
Sachant que le gène ABL du chromosome 9 était un proto oncogène, les chercheurs ont voulu déterminer si ce gène était transloqué sur le chromosome 22 au cours de la formation du chromosome Philadelphie.
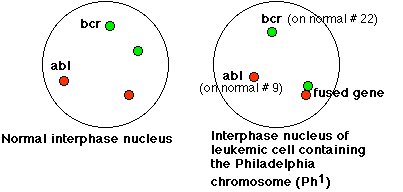
Le cliché d’hybridation in situ du document : Une conséquence génétique (moléculaire) de l’anomalie chromosomique met en évidence les gènes BCR et ABL dans une cellule normale et dans 5 cellules leucémiques d’un patient atteint de LMC.
Cette hybridation a été réalisée sur des cellules interphasiques, ce qui explique qu’on ne distingue pas les chromosomes des noyaux. Dans une cellule normale, on voit deux tâches vertes qui correspondent chacune à un allèle du gène BCR situé sur un des chromosomes 22. De même, on voit deux tâches rouges qui correspondent chacune à un allèle du gène ABL situé sur un des chromosomes 9. On peut demander de schématiser la localisation des allèles de chacun de ces gènes sur les chromosomes.
Dans toutes les cellules leucémiques, on distingue une tâche verte et une tâche rouge qui correspondent respectivement à un allèle du gène BCR et à un allèle du gène ABL. En outre, on distingue dans chaque cellule leucémique une tâche rouge associée à une tâche verte. Cela correspond à un allèle du gène BCR associé à un allèle du gène ABL sur un même chromosome, le chromosome 22. Le schéma ci-dessous est une interprétation des figures d’hybridation
D'après : Chronic Myelogenous Leukemia (CML)
Le schéma sur la localisation chromosomique des allèles BCR et ABL, conclusion de cette expérience d’hybridation, traduit bien que le gène ABL a été transloqué du chromosome 9 au chromosome 22. A ce stade, on ne peut pas vraiment parler de fusion entre les deux gènes, ils apparaissent comme juxtaposés sur le chromosome Philadelphie.
Les informations fournies par les séquences
En 1984, on a identifié dans les cellules leucémiques un ARNm qui code pour une protéine BCR-ABL non présente dans les cellules normales.
![]() Fichier BCRABL-BCR-ABL.edi
Fichier BCRABL-BCR-ABL.edi
La comparaison avec Anagène de la séquence de cette protéine avec celle de la séquence de la protéine BCR puis avec celle de la protéine ABL d’une cellule normale révèle que la protéine BCR-ABL est une protéine chimère dont la région amont correspond à celle de la région amont de la protéine BCR et la région suivante à celle de la région aval de la protéine ABL. Le dotplot visualise bien cette constitution chimérique de la protéine BCR-ABL.

Cela signifie que le gène codant pour cette protéine est aussi un gène chimère. Autrement dit, les gènes BCR et ABL ont été coupés au cours de la translocation et il en est résulté un gène de fusion au lieu de deux gènes, gène qu’on désigne aussi par BCR-ABL. C’est ce que traduit le schéma sur le chromosome Philadelphie du document.

Il restait à déterminer si la protéine codée par ce gène de fusion, engendré par la translocation, était bien responsable de la cancérisation de la cellule.
Une confirmation expérimentale de l’action oncogénique de la protéine BCR-ABL
Cette expérience de transgénèse conduit à des souris qui ont intégré dans le génome de leurs cellules souches de la moelle osseuse, le transgène BCR-ABL humain. Les souris donneuses et receveuses sont de même lignée, ce qui évite un rejet des cellules injectées par les receveuses. Quelques semaines après l’injection, un frottis sanguin réalisé chez les souris receveuses montre une richesse en globules blancs, en particulier en polynucléaires nettement supérieure à la normale. Dans leur article, les auteurs indiquent 15000 à 500000 leucocytes par mm3 alors que le nombre normal est de 5000 par mm3. D’autre part la rate est hypertrophiée.
Ce sont là des données qui évoquent celles observées chez un patient humain atteint de LMC au cours de la phase chronique. Cela n’est pas observé chez des souris irradiées ayant reçu des cellules souches n’ayant pas incorporé le transgène BCR-ABL. On peut donc conclure que la protéine codée par le transgène a la propriété de déclencher une multiplication anormale des cellules souches granuleuses de la moelle osseuse.
