La dégénérescence neurofibrillaire (DNF)
Mise en évidence de l'implication de la protéine Tau hyperphosphorylée dans la dégénérescence neurofibrillaire de type Alzheimer
En 1907, Aloïs Alzheimer étudie le cerveau d’une patiente démente, Auguste D..., décédée à l'âge de 53 ans. Il met en évidence les deux types de lésions cérébrales qui caractérisent ce qui s'appelle maintenant la "maladie d'Alzheimer". Il utilise, alors, la technique histologique d'imprégnation argentique qui avait été mise au point quelques années plus tôt par un autre médecin microscopiste, Max Bielschowsky. Le principe, bien que mal compris, en est simple. La tranche de tissu est trempée dans une solution de sels d’argent, par exemple une solution de nitrate d’argent. L’argent est ensuite « révélé », comme une photographie, par un réducteur : l’apport d’un électron transforme l’argent ionique, soluble, en argent métallique, insoluble, qui précipite sur la coupe. Or, cette précipitation ne se fait que sur les structures fibrillaires, ce qui les rend visibles en les marquant en noir comme sur un négatif photo.
Aloïs Alzheimer réalise, alors, deux observations au niveau de la substance grise corticale, chacune est une accumulation de fibres nerveuses mais avec des localisations différentes.
- La première concerne une accumulation de fibres nerveuses dans le milieu extracellulaire formant ainsi des plaques amyloïdes ou plaques séniles.
- La seconde correspond à une accumulation de fibres nerveuses, appelée neurofibrille, dans le milieu intracellulaire. Celle-ci provoque la mort du neurone, on parle de dégénérescence neurofibrillaire.
Ces deux types de lésions cérébrales caractérisent ce qui s'appelle maintenant la "maladie d'Alzheimer"
La dégénérescence neurofibrillaire touche deux secteurs du neurone :
- en périphérie du noyau, dans le péricaryon (ou soma ou corps cellulaire), souvent à proximité de dépôts lipofuschiniques. Elle n’affecte pas l’axone proximal. Elle est constituée de masses argyrophiles plus ou moins fibrillaires, de tailles et de formes variables suivant les cellules dans lesquelles elle se développe.
- en dehors du corps cellulaire, dans le neuropile (zone dans le cortex cérébral de la substance grise occupée par des prolongements divers (dendrites, collatérales axoniques, articulations synaptiques)). Ces accumulations situées dans les prolongements cellulaires sont appelées enchevêtrements neurofibrillaires ou fibres tortueuses.
C'est par des observations en microscopie électronique que Michael Kidd, de l’universalité de Londres, a démontré, en 1961, que les fibrilles anormales de la dégénérescence neurofibrillaire sont des filaments appariés en hélice, d'où le nom de PHF, "paired helical filaments" des anglo-saxons (paires hélicoïdales de filaments en Français). Ces filaments ont un diamètre de 10 nanomètres et un pas d’hélice de 80 nm.
Ainsi, les "PHF" sont une signature morphologique de la dégénérescence neurofibrillaire de type Alzheimer. Les PHF semblent spécifiques à l'espèce humaine. En 1985, Jean-Pierre Brion, de l’université de médecine de Bruxelle, montrait que des anticorps, dirigés contre les protéines tau, mettent en évidence la dégénérescence neurofibrillaire. Ensuite, il a été confirmé par de nombreuses équipes que les protéines tau sont les constituants majeurs des PHF. Des anticorps contre les sites de phosphorylation, comme l'anticorps monoclonal AD2, révèlent la dégénérescence neurofibrillaire (DNF). Iqbal démontre ainsi, en 1986, que les PHF sont des filaments pathologiques constitués de protéines tau anormalement hyperphosphorylées.
Les caractéristiques physiologiques de la protéine Tau
Cette protéine existe dans le cerveau « sain ». On sait depuis les années 1970 qu’elle s’associe aux microtubules, structures filamenteuses du cytosquelette, qui servent au transport intracellulaire des organites et à l’organisation spatiale de la cellule.
Les microtubules sont constitués par l’assemblage de dimères de tubuline. Ils constituent de véritables rails, que les protéines tau stabilisent à la manière de traverses. Sur ces rails voyagent des vésicules, wagons enfermant les organites et les molécules à transporter. Les microtubules véhiculent ainsi des matériaux synthétisés par le corps cellulaire des neurones et les acheminent vers les terminaisons axonales, situées, à notre échelle, à des kilomètres de distance (les extensions de certaines cellules nerveuses humaines mesurent pas loin de 1 mètre de long !).
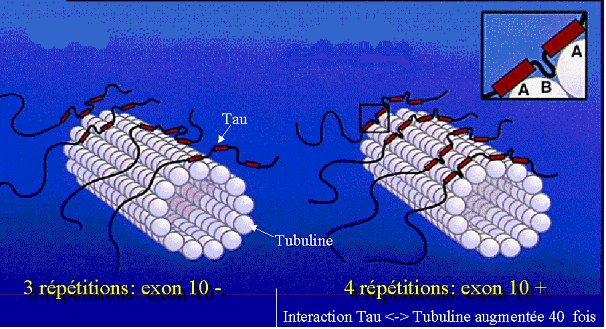

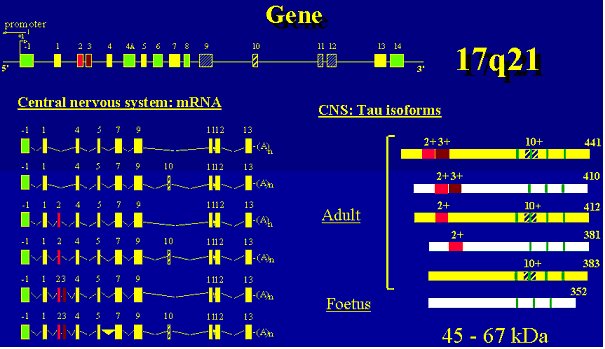
Il existe en fait six variantes de protéine tau chez l’adulte. Ces six isoformes se distinguent notamment par la répétition d’un motif particulier, noté R. Trois d’entre elles répètent le motif trois fois, les trois autres le répètent quatre fois. On parle de variantes 3R ou 4R. Ces motifs R constituent le point d’ancrage de la protéine tau sur les microtubules. Les protéines tau 4R, mieux fixées aux microtubules que les variantes 3R, le consolident, donnant des prolongements plus longs et plus rigides. Suivant les variantes de protéines tau qu’ils expriment, les neurones arborent ainsi une silhouette différente. Elles sont toutes synthétisées à partir du même gène, situé sur le bras long du chromosome 17. Ce gène possède 14 exons ; les protéines tau différent par l’insertion des régions peptidiques codées par les exons 2, 3 et 10 (épissage alternatif).
Ainsi il existe 3 isoformes avec la région exon 10 (10+) et trois isoformes sans la région de l'exon 10 (10-)
La région peptidique de l'exon 10 correspond à une quatrième zone répétée (R), point d'ancrage complémentaire sur le dimère de tubuline. Il y a donc 3 isoformes 3R et 3 isoformes 4R. Les 3R sont 10- et les 4R sont 10+. Les isoformes tau avec la région "exon 10" se fixent plus fortement à la tubuline, et stabilisent davantage les microtubules.
Un deuxième mécanisme semble contrôler plus finement encore l’action stabilisante des protéines tau. Il s’agit d’un processus dit de « phosphorylation », selon lequel un groupement phosphate se lie à certains acides aminés de la protéine tau.
Les protéines tau sont normalement phosphorylées sur de nombreux sites (Sérine Thréonine). Leur nombre est variable mais, de façon générale, on observe que plus cette protéine est phosphorylée moins elle interagit avec le microtubule.
Il existe des anticorps qui reconnaissent ces sites (ex AT8, AD2)
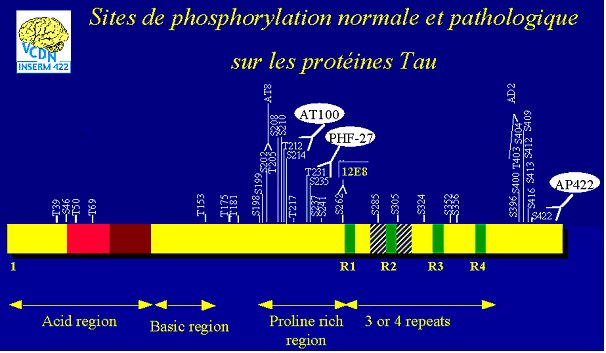
D’autres anticorps reconnaissent les sites de phosphorylation "pathologiques" (observés uniquement sur les protéines tau des filaments pathologiques) par exemple : AT100, PHF-27, AP422.
Formation et rôle de la protéine Tau non pathogène
Les protéines Tau s'associent aux microtubules de tubuline et assurent ainsi l'organisation et la polymérisation des microtubules. L'axone de la cellule nerveuse est particulièrement riche en ces protéines, permettant la stabilisation du cytosquelette axonal.
L'activité de la protéine Tau est modulée par son degré de phosphorylation. Le gène des protéines tau n'est présent qu'en une seule copie chez l'Homme, la souris, le rat et le bœuf (Drubin et al., 1984 ; Neve et al., 1986 ; Himmler, 1989). Chez l'Homme, ce gène a été localisé par hybridation in situ sur le bras long du chromosome 17, à la position 17q21 (Neve et al. , 1986).
protéine tau pathogène
L'augmentation intracellulaire en Ca2+ induite par l'accumulation extracellulaire de la protéine Abéta entraînerait l'hyperphosphorylation de la protéine Tau et donc la formation de filaments hélicoïdaux appariés que l'on retrouve dans les enchevêtrements neurofibrillaires. Normalement la protéine Tau est phosphorylée 2 ou 3 fois alors que dans la MA, elle l'est de 5 à 9 fois. Ces groupements supplémentaires gênent la polymérisation des microtubules.
- A l'échelle de la microscopie optique, la dégénérescence neurofibrillaire (DNF) correspond à l'accumulation de fibrilles pathologiques surtout dans le cytoplasme des cellules pyramidales du cortex cérébral associatif et de la structure hippocampique.
- A l'échelle de la microscopie électronique, les neurones en DNF montrent des structures hélicoïdales, les PHF (paires de filaments de la protéine tau hyperphosphorylées en hélice). Ces filaments ont un diamètre de 10 nm et un pas d'hélice de 80 nm.
- A l'échelle moléculaire, les protéines Tau forment une famille de protéines dont la masse moléculaire s'échelonne de 45 à 62 kilodaltons. Au cours de la MA, une phosphorylation anormale des protéines Tau aboutit à la formation de trois variants pathologiques, appelés Tau 55, 64 et 69 en fonction de leur masse moléculaire.
Les protéines Tau pathologiques sont d'excellents marqueurs biochimiques du processus dégénératif de type "Alzheimer" (Vermersch et al. 1992).
Les différentes « tauopathies » : maladies neurodégénératives liées à la protéine tau
L’accumulation des protéines tau dans les neurones concerne plus de 20 maladies neurodégénératives différentes. Elle est même parfois la seule cause de la maladie. Au moins quatre grandes classes d’amas de protéines tau inactivées signent quatre types de pathologies tau :
- La classe 1 avec des amas tau de type 3R et 4R (maladie d’Alzheimer, trisomie 21 et quelques autres pathologies rares).
- La classe 2 avec des amas de variantes 4R (paralysie supranucléaire progressive et dégénérescence corticobasale, deux syndromes parkinsoniens).
- La classe 3est caractérisée exclusivement par des amas de protéines tau 3R (maladie de Pick, une sous-classe de démence fronto-temporale).
- La classe 4 est observée dans la maladie de Steinert, une pathologie neuromusculaire familiale qui implique une dérégulation des ARN messagers de tau indépendante des motifs R.
La dégénérescence neurofibrillaire et l'implication des protéines Tau
La dégénérescence neurofibrillaire (DNF) est une des deux lésions (avec les plaques amyloïdes) caractéristique de la maladie d’Alzheimer. Dans les stades très avancés de la maladie d’Alzheimer, on peut observer des plages de DNF au niveau du cortex cérébral. Celles-ci correspondent à des zones à l’intérieur desquelles la population neuronale a fini par mourir. Les neurones atteints mais qui ne sont encore pas entrés en apoptose, présentent, autour du noyau et dans les prolongements cellulaires, des paires de filaments appariés en hélice (PHF).
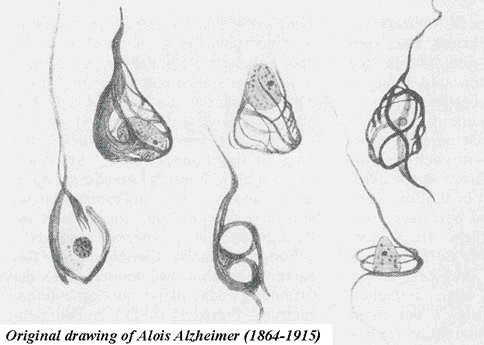
Les PHF sont des marqueurs de la DNF.
Les techniques immuno-histochimiques ont montré qu’ils sont formés de protéines tau.
De temps en temps, chez un sujet normal, les protéines Tau se détachent. Elles sont donc remplacées et dégradées rapidement.
Mais chez un sujet atteint de la maladie d’Alzheimer, les protéines Tau se détachent des microtubules, et restent dans le milieu intracellulaire. Elles ne sont pas toutes dégradées et vont donc s'agréger. C'est cela qui va former les PHF. Lorsque ceux-ci sont trop importants, ils modifient l’organisation spatiale et le transport intracellulaire des organites bloquant le fonctionnement du neurone et provoquant sa mort.
Il existe plusieurs explications au détachement des protéines Tau :
- la phosphorylation : c'est ce qui permet la fonctionnalité de la protéine. La protéine Tau est très peu phosphorylée et lorsqu'elle est hyperphosphorylée, elle ne peut pas s'attacher aux microtubules : on parle de protéine tau pathologique. Ce sont donc les protéines qui se détachent et s'accumulent en formant des neurofibrilles. Dans cette explication, la cause de l'augmentation de la phosphorylation est inconnue.
- les variantes de la protéine tau : il existe deux sortes de protéine tau, celles présentant trois point d’ancrage aux microtubules (variante 3R) et celles qui en présentent quatre (variante 4R). Les formes 4R de la protéine tau stabilisent davantage les microtubules
Les protéines Tau peuvent subir différentes mutations.
Le chemin séquentiel de la pathologie Tau au cours du viellissement et de la maladie d'Alzheimer
Les protéines tau pathologiques peuvent être révélées par immuno-empreintes (western blot). Pour cela, la sonde utilisée est l’anticorps monoclonal AD2 dirigé contre un site de phosphorylation. A partir d’une banque de cerveaux, différentes régions cérébrales ont été étudiées par cette technique. Elles sont désignées en fonction de la nomenclature de Brodmann (ex : aire 21 = temporal moyen).La dégénérescence neurofibrillaire n’est pas située au hasard dans le cerveau, mais elle suit un chemin séquentiel de propagation.
Nous pouvons distinguer 10 Stades d'invasion de la pathologie tau, qui correspondent aux 10 régions cérébrales touchées successivement, selon un ordre pratiquement invariable, hiérarchique (de la région hippocampique vers les régions très associatives, puis vers les régions corticales primaires).
Plus la pathologie tau avance dans le cortex, plus le chemin devient variable, selon la vulnérabilité individuelle. La variation de l’atteinte des régions du cortex associatif puis primaire provoque les variations cliniques interindividuelles marquées. C’est pour cela que la maladie d’Alzheimer a un profil général et statistique assez précis et constant, mais que chaque cas à sa spécificité.
| Stade évolutif et caractéristiques | Représentations |
|
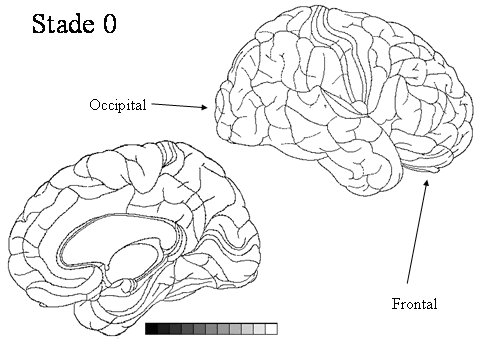
STADE 0 : pas de détection de PHF-Tau aucune région cérébrale n'est affectée par la dégénérescence neurofibrillaire. c'est de qui est observé dans la population générale jeune (moins de 70 ans) |
 |
| Toutes les personnes âgées de plus de 75 ans ont une pathologie tau dans cette région
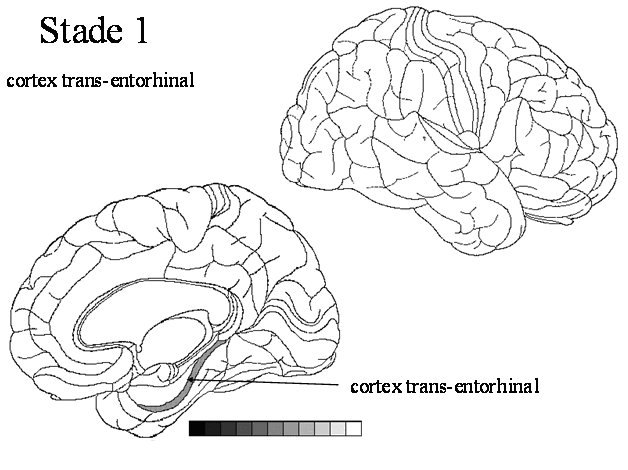
STADE 1 : cortex transentorhinal Toutes les personnes âgées de plus de 75 ans ont une pathologie tau dans cette région Cette région charnière fait partie du cortex limbique (cortex associé à la mémoire et aux émotions) Il s'agit de la région la plus vulnérable du cerveau humain à la pathologie tau. |
 |
|
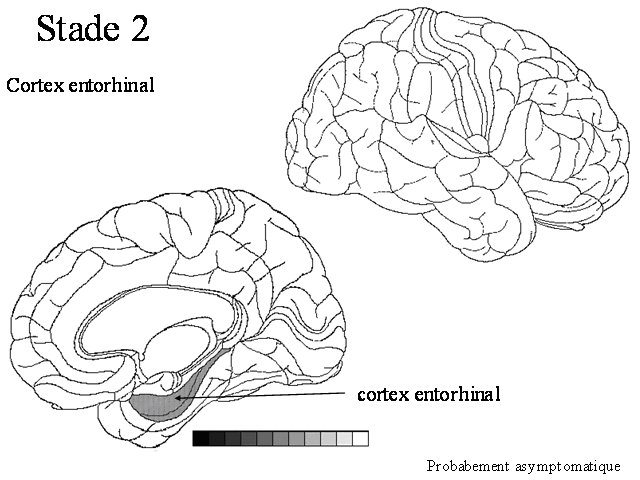
STADE 2 : cortex entorhinal ou aire de Brodmann 28 Le stade 2 semble cliniquement silencieux. A ce stade, il n'y a pas toujours de dépôts amyloïdes |
 |
|
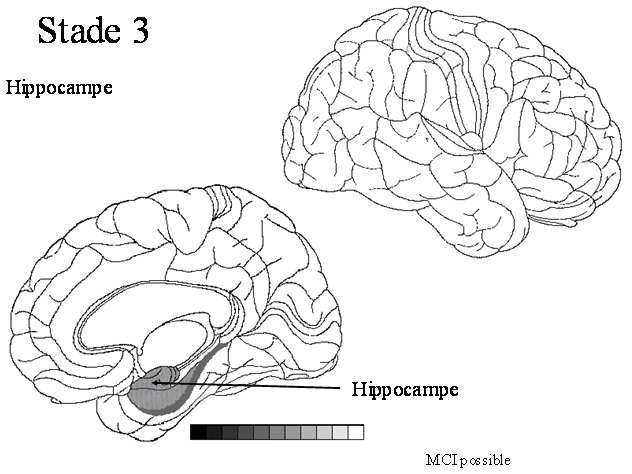
STADE 3 : Hippocampe
La région hippocampique est une région vulnérable à la pathologie tau au cours du vieillissement. Cette région comme les deux précédentes sont situées à un carrefour important où transitent toutes les informations concernant la mémoire. Cette région peut être atteinte par la pathologie tau sans avoir de dépôts amyloïdes Des troubles cognitifs discrets (MCI) sont probables à ce stade. MCI veut dire Mild cognitive impairment (troubles cognitifs légers et avant-coureur de la maladie d’Alzheimer) |
 |
|
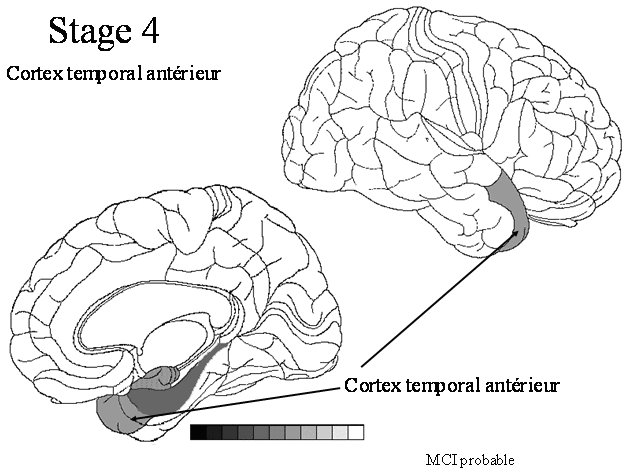
STADE 4 :pôle temporal ou aire de Brodmann 38
Cette aire de Brodmann 38 est également une région « limbique » comme l’hippocampe. A ce stade, on trouve généralement des dépôts discrets de substance amyloïde. Le MCI est presque systématique |
 |
|
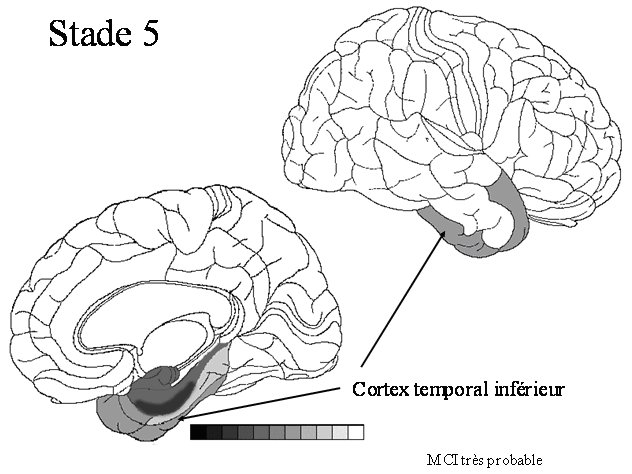
STADE 5 : cortex temporal inférieur ou aire de Brodmann 20
Les dépôts d’amyloïde, sauf cas exceptionnels sont présents dans le néocortex. On observe une agrégation du peptide AB 42. Les troubles cognitifs sont généralement légers. |
 |
|
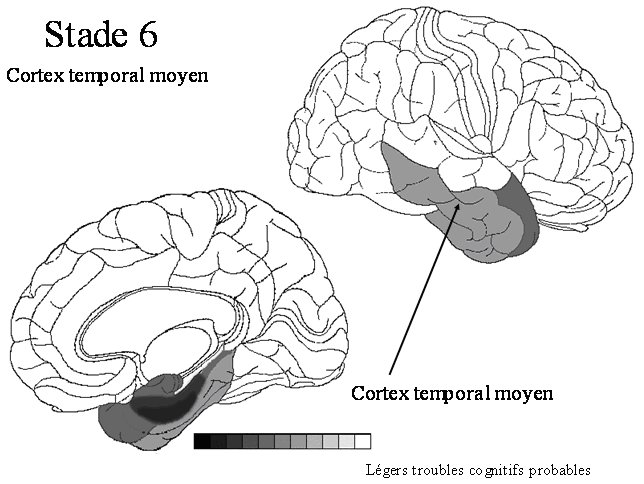
STADE 6 : cortex temporal moyen Il s’agit d’une évolution du stade 5, tant pour la pathologie tau, les plaques amyloïdes que pour les signes cliniques. |
 |
|
STADE 7 : cortex polymodal associatif
La dégénérescence neurofibrillaire va s'installer simultanément dans toutes les régions corticales associatives (polymodales): le cortex frontal antérieur, le cortex temporal supérieur, le cortex pariétal inférieur A ce stade, les troubles cognitifs peuvent correspondre aux premiers stades de la maladie d’Alzheimer. Les dépôts d’amyloïdes sont significatifs. |
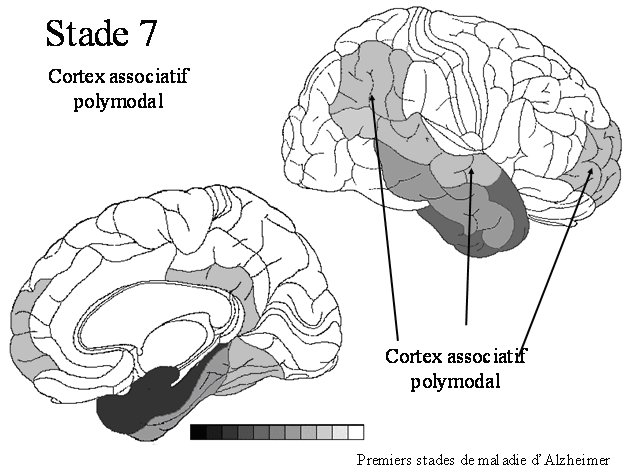 |
|
STADE 8 : cortex unimodal dont l'aire de Brodmann 44 (aire de Broca)
Ensuite, les régions moins associatives (dites "unimodales") sont affectées par la DNF, telle l'aire de Broca (aire de Brodmann 44) Il s’agit d’une avancée dans la maladie d’Alzheimer. On peut penser qu’il correspond aux formes modérées de la maladie d’Alzheimer. On peut noter que la progression de la pathologie tau est accompagnée en parallèle par une intensification des processus dégénératifs dans les premières régions touchées (région hippocampique) |
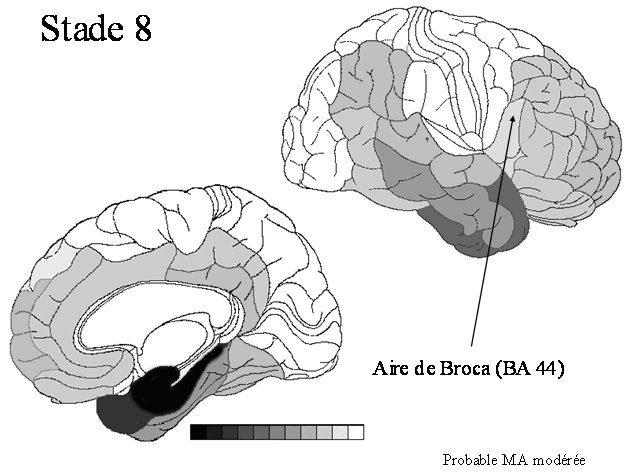 |
|
STADE 9a, b, c : cortex secondaire moteur et sensitif
La DNF va envahir ensuite les régions corticales primaires, visuelles et/ou motrices. Les dépôts d’amyloïdes sont très importants. Il s’agit d’un stade sévère de la maladie d’Alzheimer. |
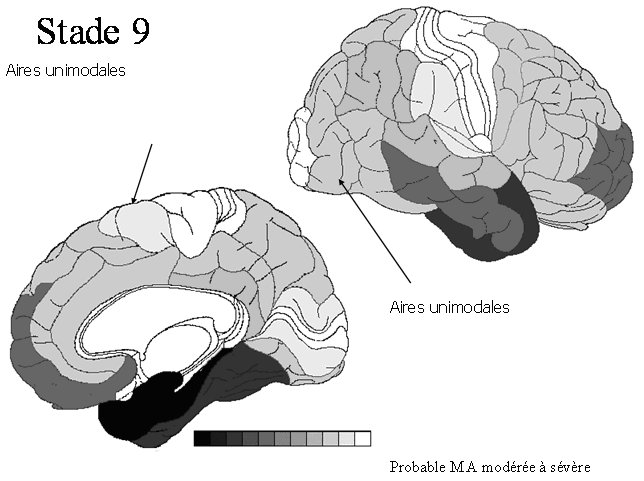 |
|
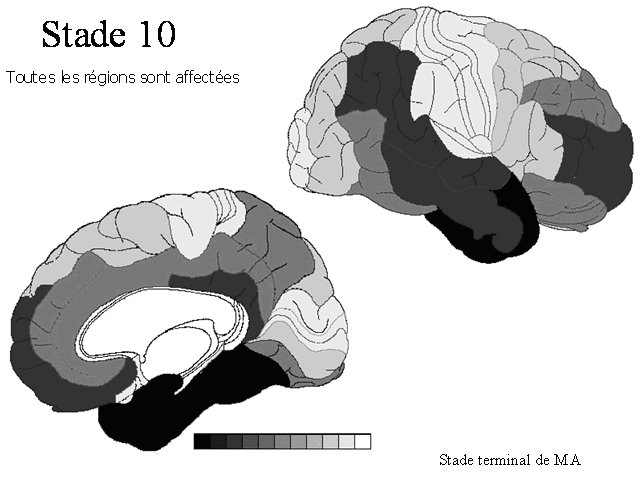
STADE 10 : cortex primaire moteur et sensitif
Dernier stade d'invasion de la DNF, puisque toutes les régions corticales sont affectées, ainsi que de nombreux noyaux sous corticaux. Les dépôts amyloïdes sont très importants. |
|
sources :
adna : http://www.alzheimer-adna.com/Neuropath/DNF.html
http://www.alzheimer-adna.com/Stades/10stadesFr.html
- Cerveau & Psycho : n°26 – Bimestriel mars – avril 2008 : article « le cerveau malade à la loupe » de Charles DUYCKAERTS p 60-65
- LA RECHERCHE HORS SÉRIE N° 48 10 - CERVEAU SANS MÉMOIRE - JANVIER 2003
- wikipédia : http://fr.wikipedia.org/wiki/Maladie_d%27Alzheimer
onra : http://cm2r.enamax.net/onra/index.php?option=com_content&task=view&id=25&Itemid=46