Emergence d'un virus pandémique à partir du H5N1
Diversité génétique des virus A/H5N1
Les génomes des virus A/H5N1 isolés depuis 1997 ont été analysés. Tous sont proches d'une souche identifiée en 1996 chez une oie dans la province de Guandong en Chine (souche A/Goose/Guandong/1/96).
Tous les virus A/H5N1 responsables des épizooties et isolés des cas humains sont tous apparentés au génotype Z ( les virus grippaux de type A sont classés en six génotypes notés de V à Z). Au sein de cette souche de génotype Z les virus ont évolué en groupes phylogénétiques distincts appelées clades.
Typologie des virus grippaux selon leurs antigènes ou leur génome Nucléoprotéine Hémagglutinine et neuraminidase - Types A, B, C - Sous types - Variants A H5N1 H5N1/Indonesia/5/2005/ Séquence des segments d'ARN Séquence du gène codant l'hémagglutinine - Génotypes - Clades (1,2) - Sous clades Z 2 2.1Typage Support Spécificité Exemple antigénique génétique
D'après "La grippe en face" Y Buisson, E. Nicand et P Saliou, Edition Xavier Montauban
En 2007, trois clades ont été caractérisées:
- les virus de clade 1
§ chez les oiseaux et les hommes
- au Vietnam en 2004
- au Cambodge en 2004
- en Thaïlande en 2006
§ uniquement chez les oiseaux
- au Laos
- en Malaisie
- les virus de clade 2
Ils se différencient des virus de clade 1 par une délétion de 22 acides aminés au niveau de la tige de la neuraminidase.
On distingue trois sous clades 2.1, 2.2 et 2.3 . Ces virus de clade 2 ont circulé en 2005 et 2006 dans les populations d'oiseaux essentiellement en Chine, Indonésie, Moyen Orient, Europe et Afrique. Les cas humains répertoriés ont présenté des sous-clades différents:
- Indonésie :sous clade 2.1
- Iran, Egypte, Djibouti et Nigéria :sous clade 2.2
- Chine et Laos :sous clade 2.3
- les virus de clade 3 sont ressensés depuis 1997 mais leur circulation reste limitée à l'heure actuelle à l'Asie du sud est
Les modifications observées au niveau de l'hémagglutinine
- Au niveau du site de liaison de l'hémagglutinine (H5) au récepteur, appelé site RBS, avec les acides sialiques de la cellule cible
L'étude du site RBS (Receptor Biding Site) présent sur les hémagglutinines des virus humains et aviaires a montré que le domaine protéique formant ce site de liaison comporte onze acides aminés impliqués dans la spécificité d'attachement alpha(2-3) ou alpha(2-6) des acides sialiques. Les modifications affectant le site RBS de H5 avec les cellules cibles vont entraîner des changements du tropisme du virus pour l'espèce. Les modifications suivantes (les plus fréquemment répertoriées) contribuent à une reconnaissance possible des acides sialiques SA alpha(2,6)-Gal présents sur les cellules des voies respiratoires supérieures humaines par l'hémagglutinine H5 , augmentant ainsi la possibilité de transmission inter-humaine.
Rappelons que, chez les oiseaux, l’acide sialique alpha(2,3) est surtout présent dans l’intestin tandis que chez l’homme, la forme alpha(2,6) se trouve dans les voies respiratoires supérieures (trachée), sur des cellules non-ciliées. Toutefois, les cellules ciliées des bronchioles pulmonaires expriment la forme alpha(2,3) de l’acide sialique reconnue par le virus aviaire. Ces cellules ciliées doivent très certainement être la cible de l’attaque virale H5N1 aviaire chez les personnes exposées en permanence aux volailles.
| Acide aminé concerné | acide aminé initial changé en un autre acide aminé par mutation du gène |
| résidu 182 | Asparagine remplacé par la Lysine |
| résidu 192 | Acide glutamique remplacé par l'Arginine |
| résidu 126 | Sérine remplacé par la Leucine |
Parmi les mutations prcédentes, des virus isolés de cas mortels en 2005 à Hong Kong et comparés à ceux dejà obtenus en 2003 ont montré que la modification du résidu 126 est responsable en plus d'une très forte virulence chez les oiseaux terrestres.
Une autre mutation favorise l'accrochage des virus aux cellules humaines, elle se situe au niveau des acides aminés 226 et 228. En effet, dans la forme aviaire du virus, elle contient deux acides aminés jouant un rôle clé, une glutamine en position 226 et une glycine en position 228 : l’arrangement spatial de ces deux acides aminés forme ainsi une petite poche qui se fixe sur la molécule d’acide sialique alpha(2,3) de la membrane cellulaire de la cellule hôte. D’un autre coté, la forme humaine contient une leucine en position 226 et une sérine en position 228, qui forme une poche plus large englobant préférentiellement la forme alpha(2,6) de l’acide sialique.
- Au niveau du site de clivage de Ha en Ha1 et Ha2
La deux parties Ha1 at Ha2 de l'hémagglutinine sont reliées par un site de clivage bien identifié. La séparation des deux parties est une étape nécessaire pour que le virus ait la capacité d'infecter la cellule hôte. Chez les virus grippaux saisonniers de sous-type A/H3N2 , le clivage est réalisé par des protéases spécifiques présentes en surface des cellules hôtes. Le clivage s'effectue ainsi après la sortie des virions à l'extérieur des cellules épithéliales des voies aériennes. Chez le virus H5N1, ce site de clivage est multibasique (caractéristique des virus hautement pathogène) et permet un clivage intracellulaire par des protéases beaucoup moins spécifiques présentes dans de nombreux types cellulaires.
Les modifications du site de clivage (par exemple le passage d'un site type RETR vers un site type RERRRKKR multibasique) vont entraîner des changements de tropisme du virus pour les organes. Le site de clivage multibasique (à droite) des virus hautement pathogènes comme le H5N1 donne lieu à une infection systémique c'est à dire de nombreux tissus de l'organisme.
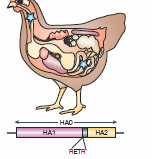 | 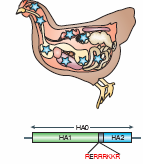 |
| Le site de clivage présentant les acides aminés RETR (arginine, acide glutamique, thréonine, arginine) ne permet qu'une infection des tissus respiratoires et digestifs. | Le site de clivage présentant de nombreux acides aminés basiques RERRRKKR (arginine, acide glutamique, arginine, arginine, arginine,lysine, lysine, arginine) permet une infection par le virus de divers tissus comme les poumons, le foie, la rate le rein le cerveau et le tube digestif. |
Les modifications observées au niveau de la sous unité PB2 de la polymérase virale
Les virus aviaires ont besoin d'une température élevée de 41°C pour se répliquer, chez l'homme la température corporelle n'est que de 37°C et légèrement inférieure encore au niveau des voies aériennes supérieures. La capacité du virus aviaire à se multiplier dans une cellule humaine et à se transmettre à d'autres cellules humaines est augmentée, grâce à une mutation qui semble jouer sur la thermosensibilité du virus. Cette mutation affecte l'acide aminé 627 de la protéine PB2. Cette mutation entraine le remplacement de l'acide glutamique trouvé dans le PB2 des virus aviaires faiblement pathogènes par de la lysine en position 627. Cette mutation semble suffisante pour rendre possible l'infection humaine par les virus devenus alors hautement pathogènes. La modification de la PB2 augmente la capacité d'un virus issu d'un réservoir aviaire, comme le H5N1, à se multiplier dans une cellule humaine.
Les modifications observées au niveau de la protéine NS1
Il a été reporté que la virulence des virus Inflenza de type A est augmentée en présence d'une mutation sur la protéine interne NS1. Cette mutation concerne l'acide aminé 92 qui est représenté par un acide glutamique alors que normalement ce résidu 92 montre une asparagine. La présence de cet acide glutamique confère au virus une résistance accrue face à l'action antivirale des interférons ainsi qu'aux facteurs de nécrose tumorales alpha sécrétés par la cellule hôte. Les modifications au niveau de la molécule NS1 confèrent au virus un accroissement de sa résistance face aux systèmes de défense des cellules cibles.
