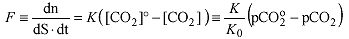- 2. Les échanges de dioxyde de carbone entre l'air et l'eau
La pression partielle actuelle du dioxyde de carbone dans l'atmosphère est d'environ 360 µatm. Ce gaz est soluble et se trouve présent dans toutes les eaux naturelles sous forme de molécules neutres que, pour simplifier, l'on note C02aq.
Dans la phase liquide les molécules sont en état d'agitation permanente. Parmi les molécules de gaz dissous qui s'approchent de l'interface, un pourcentage constant acquiert, par le hasard de collisions favorables, une énergie suffisante pour passer à l'état gazeux et s'échapper du liquide. Le taux d'évasion est proportionnel à la concentration volumique du gaz dissout.
C'est la même chose pour la phase gazeuse. A chaque instant la surface du liquide est frappée par une quantité statistiquement constante de molécules de gaz. La plupart rebondissent, mais une fraction constante s'englue à l'interface. Le nombre de molécules qui se mettent ainsi en solution par unité de surface et par unité de temps est proportionnel à la densité spatiale des molécules dans la phase gazeuse, donc à la pression partielle du gaz.
L'équilibre CO2 gaz <--> CO2aq. obéit à la loi de Henry :
[C02]aq = Ko . pCO2
expression dans laquelle pCO2 est la pression partielle du CO2 dans la phase gazeuse. Ko est le coefficient de solubilité du CO2. Il diminue lorsque la température et de la salinité augmentent, ce qui conduit à une augmentation de la pression partielle en CO2 (et donc à un dégazage de l'océan). Bien que virtuelle, la pCO2 d'une eau est une grandeur mesurable, c'est celle que l'on observerait dans une phase gazeuse mise en équilibre avec cette eau de mer.
Dans les conditions naturelles, l'équilibre océan-atmosphère n'est presque jamais réalisé. Dans les eaux de surface, les phénomènes physiques et biologiques provoquent des écarts à la saturation que la lenteur des échanges avec l'atmosphère ne parvient pas à résorber.
Lorsqu'une eau de mer de surface, est sous-saturée ou sur-saturée en CO2, elle peut échanger du gaz avec l'atmosphère selon la relation :
F est le flux de carbone (nombre de moles traversant l'unité de surface par unité de temps).pCO2° est la pression partielle dans l'atmosphère, [C02]° la concentration qu'aurait l'eau de mer si elle était en équilibre de saturation avec l'atmosphère ; pCO2 et [CO2] sont la pression partielle et la concentration en CO2 effective de l'eau de mer. K est le coefficient de transfert (dimension d'une vitesse) et Ko le coefficient de solubilité du dioxyde de carbone (mol kg-1 atm-1ou en mol.litre-1.atm-1).
Mais le CO2 échangé avec l'atmosphère, n'est pas gagné ou perdu seulement pour le CO2 moléculaire dissous, il l'est pour l'ensemble du carbone inorganique dissous, car le CO2 est en interaction avec les ions HCO3- et CO32-.
Si l'on augmente par exemple l'abondance du gaz carbonique dans l'air; celle de l'eau doit également augmenter. Ce faisant, l'équilibre chimique dans l'eau est déplacé vers plus d'ions hydrogénocarbonates, moins d'ions carbonates et moins de gaz dissous. Il faut donc que l'océan absorbe une grande quantité de gaz carbonique pour que soient atteints à la fois l'équilibre avec l'atmosphère et l'équilibre entre espèces dissoutes. On peut ainsi prévoir qu'un état d'équilibre avec l'atmosphère sera beaucoup plus lent à s'établir que pour un gaz non réactif.
K, coefficient de transfert de la relation ci-dessus représente la vitesse d'échange du gaz. Ce coefficient représente une physique assez complexe, puisque les deux fluides, l'air et l'eau, ne sont pas au repos: l'échange de gaz entre l'océan et l'atmosphère est, par exemple, affecté par l'entraînement des bulles en subsurface ou par les variations rapides de température des premiers microns de la surface de l'eau.
En pratique, on a déterminé empiriquement des relations entre K, la température de l'eau et la vitesse du vent. Ces relations ont surtout été obtenues à partir d'expériences dans des souffleries spéciales qui permettent de créer des vagues à la surface de l'eau; on a aussi réalisé des expériences en milieux naturels, en injectant des gaz inertes dans l'eau de lacs isolés et en étudiant leur dégazage vers l'atmosphère. Ainsi de nombreuses formules empiriques ont été proposées. L'intérêt de ces formules est que l'on peut estimer K à partir de mesures de température et de vitesse du vent: alors que la mesure directe de K est compliquée, celles de la température et de la vitesse du vent sont accessibles sur tout l'océan à l'aide de satellites.
On peut trouver le temps nécessaire à l'équilibre du gaz carbonique entre la couche de mélange océanique (couche océanique homogénéisée par la turbulence induite par la tension du vent et au travers de laquelle se font les échanges air/eau) et l'atmosphère par le calcul suivant. Le coefficient K/Ko vaut de l'ordre de 40.103 mol/(m².an.atm). Pour un excès de gaz dans l'océan de 10 %, c'est-à-dire une différence (pCO2° - pCO2) de -35 µatm, on obtient un flux de dégazage de 1,4 mol/(m2.an). Les équations d'équilibre chimique indiquent que pour créer une variation relative de pCO2, de 10 %, il faut une variation relative de 1 % du carbone minéral total dissous (ou, de manière équivalente, il faut dégazer dix fois la quantité de gaz dissous en excès, puisque le gaz dissous ne fait que 1 % du carbone minéral dissous). Dans une couche de mélange océanique de 100m d'épaisseur, il y a 200 mol de carbone total dissous. Il faut donc perdre 2 mol de carbone par dégazage ; d'après le flux estimé ci-dessus, cela prendra un peu moins d'une année et demi.
Page suivante