La découverte d’une conséquence de la méthylation des exons chez l’abeille
Documents : La découverte d’une conséquence de la méthylation des exons chez l’abeille
Le diagramme précédent fait allusion à un épissage différentiel des gènes lié à une différence de méthylation. En effet, chez les insectes et notamment chez l’abeille, les sites CpG méthylés se trouvent surtout dans les exons et non dans les séquencés régulatrices des gènes. Cela a suggéré que la méthylation pouvait affecter l’épissage de certains gènes. Le premier gène qui a été envisagé est le gène GB18602 pour lequel on trouve deux variants X1 et X2 résultant d’un épissage alternatif.
La comparaison avec Anagène des séquences des deux ARN messagers résultant d’un épissage alternatif de l’ARN prémessager révèle la présence chez l’un (X1) d’un fragment absent chez l’autre (X2). Autrement dit, ce fragment présent dans l’ARN prémessager, se comporte comme un exon lors de l’épissage conduisant à X1 et comme un intron lors de l’épissage conduisant à X2.

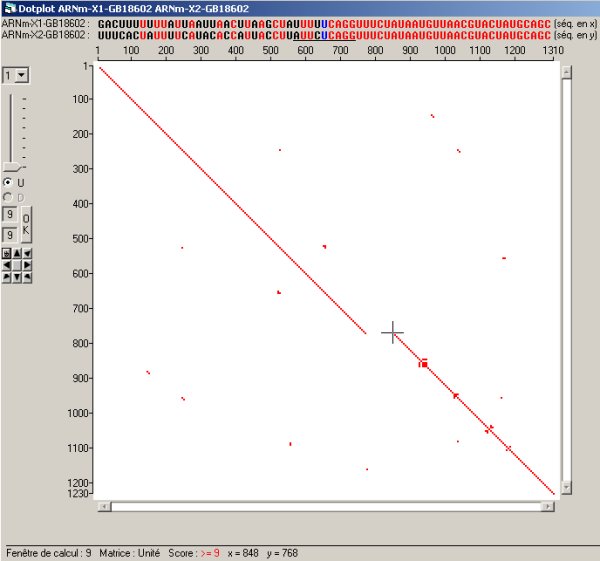
Mise en évidence du fragment différent entre les variants X1 et X2 du gène GB18602.
Cette conclusion est corroborée et visualisée par le dot plot de comparaison des deux ARNm. S’ils étaient identiques, on visualiserait une diagonale continue, en réalité elle est interrompue avec un décalage de la deuxième partie par rapport à la première. L’intervalle horizontal entre les deux portions correspond au fragment de séquence présent dans X1 (représenté horizontalement) et absent dans X2 (représenté verticalement).
· La comparaison de l’ARN prémessager avec chacun des deux ARNm permet de préciser le type de l’épissage alternatif. Cette comparaison avec le dot plot est la plus aisée à décrypter.
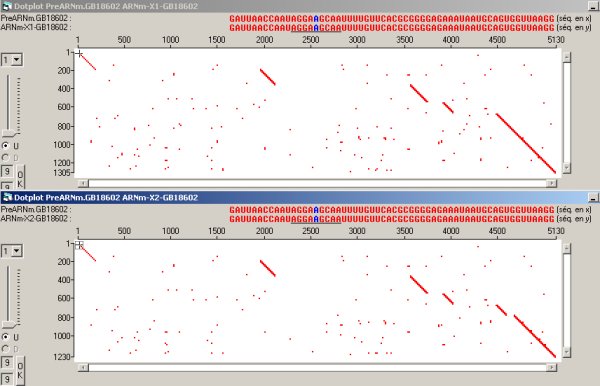
La comparaison de l’ARN prémessager avec l’ARNm X2 conduit à reconnaître 6 exons. Celle du préARNm avec l’ARNm X1 conduit à n’en identifier que 5. Les 4 premiers exons sont identiques dans les deux ARNm. La différence porte donc sur les exons 5 et 6 qui sont réunis en un seul lors de l’épissage de X1. Cela signifie que l’intron séparant les exons 5 et 6 est conservé lors de l’épissage de X1 et se comporte donc comme un exon. On parle d’épissage alternatif par rétention d’intron.
Il reste à envisager les conséquences de cet épissage alternatif sur les protéines. Pour cela on peut traduire avec Anagène la séquence codante de chaque ARNm. La traduction de l’ARNmX1 donne une protéine de 203 acides aminés ; celle de l’ARNmX2 une protéine de 247 acides aminés. C’est donc l’ARNm le plus long qui code pour la protéine la plus courte. C’est d’ailleurs pourquoi le variant X1 est dit aussi S (Short) et le variant X2 : L (Long).
Cela s’explique du fait que la rétention d’un intron lors de l’épissage de X1 conduit à un codon stop anticipé dans l’ARNm. En revanche pour le variant X2 le codon stop présent dans le dernier exon est éloigné de sorte que la protéine est plus longue.
Le graphique suivant traduit les caractéristiques de l’épissage du gène chez les reines et les ouvrières. On constate que le variant S est près de 4 fois plus exprimé chez la reine que chez les ouvrières. En revanche le variant L est également exprimé dans les deux castes.

Expression ratio : rapport de l'intensité d'expression de chaque variant X1 et X2 chez la reine par rapport à une ouvrière
Le graphique sur la méthylation des sites CpG du gène GB18602 indique que la méthylation du gène est nettement plus faible chez les reines par rapport aux ouvrières ce qui suggère une corrélation entre la méthylation et le type d’épissage.

On ignore le rôle des protéines codées par ce gène. Si les deux protéines ont un rôle différent, on voit comment un épissage différentiel en rapport avec une différence de méthylation peut contribuer à une diversité phénotypique.
Conclusion
Les études sur l’épigénétique des mammifères ont conduit à l’idée que l’état de méthylation des séquences régulatrices des gènes retentissait sur l’importance de l’expression des gènes, une très forte méthylation inhibant leur expression. L’épigénétique de l’abeille révèle une autre conséquence de la méthylation, à savoir son impact sur la nature de l’épissage des gènes. Les études récentes indiquent que cette dernière modalité n’est pas limitée aux insectes mais a aussi lieu chez les mammifère.
