Les thérapies en perspective
V. Perspectives. Les thérapies
A. Un bilan sur les thérapies géniques de la drépanocytose en constante évolution
1. Dans le prolongement des protocoles sur la thérapie génique du DICS-X, ceux sur la drépanocytose par addition d’un gène thérapeutique se sont développés durant la deuxième moitié des années 2010. Le premier patient drépanocytaire traité avec succès a été rapporté en 2017 (cas envisagé précédemment).
Les évolutions dans les protocoles portent sur différents points : recueil des CSH dans le sang et non dans la moelle osseuse par utilisation d’un produit, le plerixafor, utilisation de vecteurs lentiviraux, conditionnement des patients avant de recevoir l’injection des CSH génétiquement modifiées, estimation de la quantité de CSH à injecter.
Dans un article du « New england journal of medicine » de 2022, les médecins rapportent les résultats d’un essai clinique portant sur 35 patients aux USA. Après un suivi moyen de 17,3 mois après la thérapie (fourchette : 3,7 à 37,6 mois), la médiane du taux d’hémoglobine dans cette population est passée de 8,5 g /dl avant la thérapie à 11,0g 6 mois après. L’hémoglobine thérapeutique HbA T87Q contribuait au moins à 40% de l’hémoglobine totale, et l’hémoglobine HbS à 50%. Ces valeurs sont proches de celles qu’on trouve chez les personnes hétérozygotes bêta A//bêta S. Six mois après la thérapie, 85% des hématies contenaient de l’hémoglobine HbA T87Q et donc 15% n’en possédaient pas. Cliniquement, le principal critère de l’efficacité du traitement est l’absence de crises vaso-occluives, ce qui a été constaté. La médiane de ces crises était de 3 crises par année durant les 24 mois qui ont précédé la thérapie. Aucun cas de cancer, notamment de leucémie n’a été constaté durant cette période de suivi médiane de 17,3 mois.
Avec cette thérapie par addition où les deux allèles HbS s’expriment, il reste à savoir si l’hémoglobine thérapeutique HbA T87Q va continuer à s’exprimer. Seules des données sur un suivi pendant une dizaine d’années au moins.
2. La thérapie de la drépanocytose par édition du génome a connu un grand essor au début des années 2020. La majorité des protocoles a eu pour objectif la réactivation de la synthèse de HbF mais avec des méthodologies différentes. Le protocole suivi par l’équipe de Frangoul, envisagé précédemment, est un exemple de ce type de thérapie. Les protocoles divergent sur la manière d’obtenir cette réactivation de HbF.
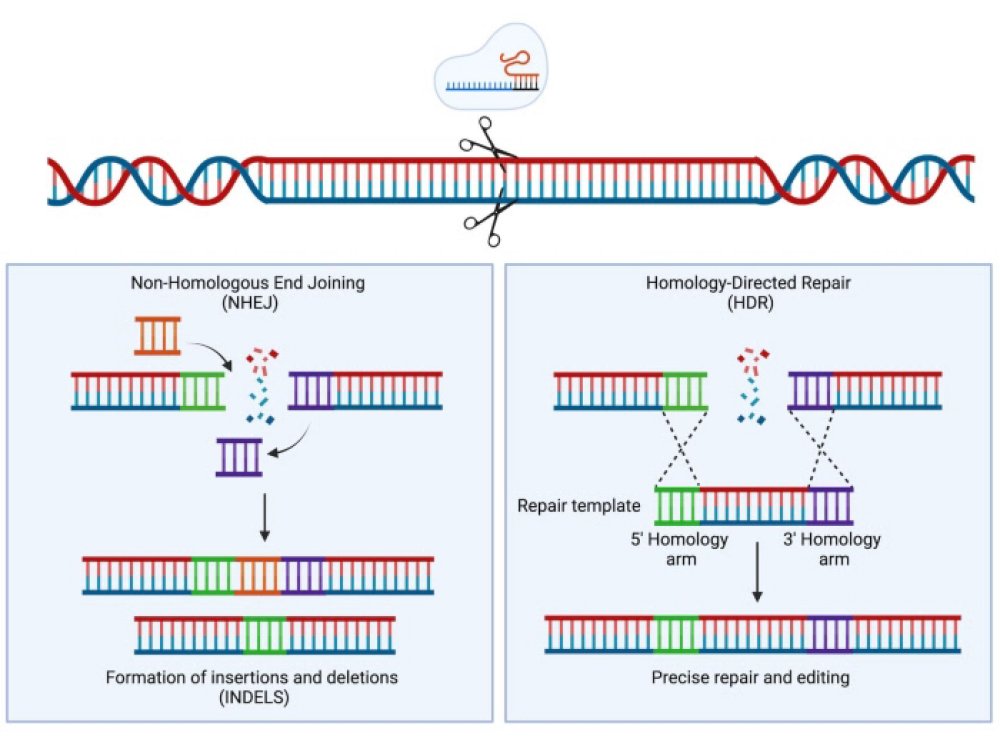
Un deuxième type de thérapie de la drépanocytose par édition du génome consiste à corriger directement la mutation dans les cellules souches hématopoïétiques du patient. L’objectif est donc d’obtenir des cellules CSH qui possèdent les allèles HBA uniquement. Les premiers protocoles expérimentés consistent à utiliser le système CRISPR Cas9 avec un ARN guide dont les 20 premiers nucléotides s’apparient avec la séquence de l’allèle bêta S à corriger. L’enzyme Cas9 réalise alors une cassure double brin entre les nucléotides 17-18 . Comme indiqué précédemment, la cellule possède deux systèmes de réparation de l’ADN : NHEJ et HDR dont les principes sont schématisés dans les figures ci-dessous.
Avec le système NHEJ (jonction d’extrémités non homologues) la cellule remet bout à bout les deux segments résultant de la coupure en introduisant des modifications, micro insertions et micro délétions. Il en résulte que la réparation est peu précise et que la fonction de la séquence cible est perdue : c’est le cas de l’enhancer du gène BCL11A.
Le système HDR ( recombinaison homologue) est plus précis, aboutissant à la modification souhaitée de la séquence. Pour que la cellule l’utilise, il faut lui fournir un ADN donneur (template).
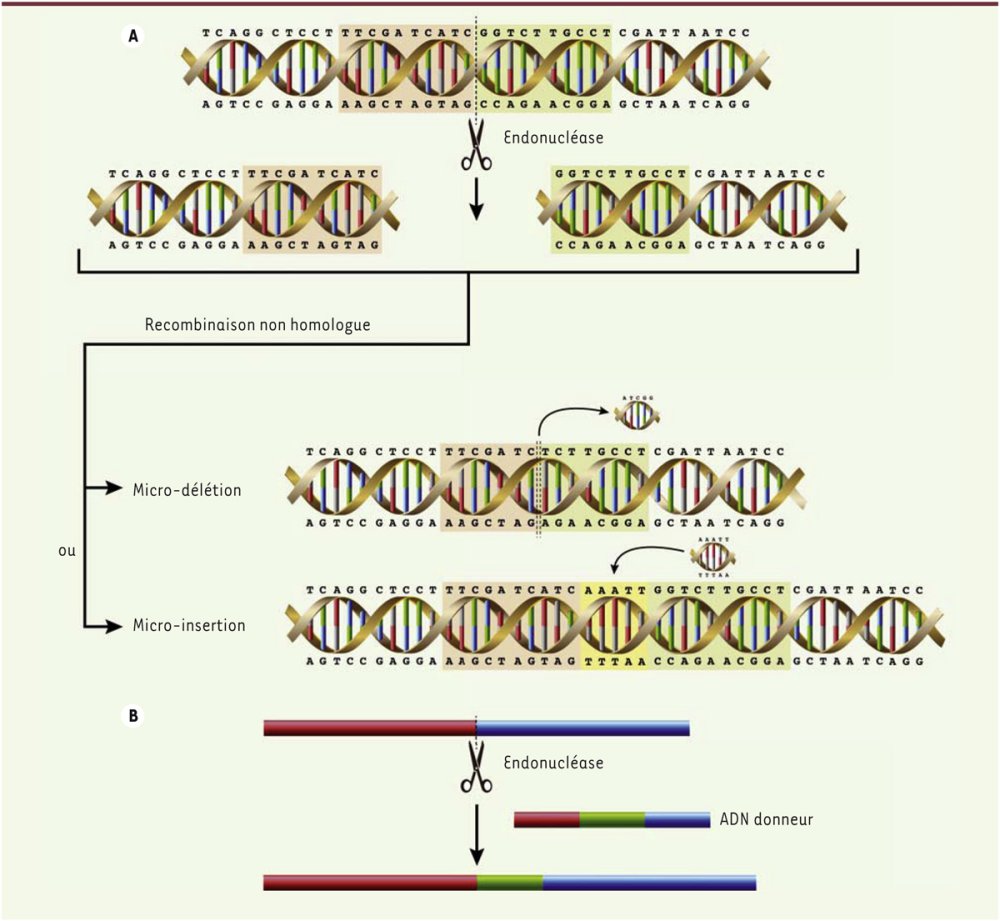
L’ADN donneur doit contenir de chaque côté de la coupure de l’ADN cible des séquences homologues allant de 50 à 200 nucléotides. Dans le cas de l’édition du gène bêta par correction de la mutation, il possède entre les deux séquences homologues le triplet normal GAG du sixième codon. Le système HDR réalise une recombinaison : échange du codon GTG muté de la séquence cible avec le codon GAG de l’ADN donneur.
Source : Ingénierie des mutations hétérozygotes oncogéniques de gain de fonction dans les cellules souches et progénitrices hématopoïétiques humaines. JoVe Journal. Published: March 10, 2023.
Représentation schématique simplifiée des deux systèmes de réparation de la cellule. A la suite d’une cassure double brin engendrée par l’enzyme Cas-9.
Source : Médecine science : CRISPR un système qui permet de corriger ou de modifier l’expression de gènes responsables de maladies héréditaires. Med Sci (Paris) 2015 ; 31 : 1014–1022.
Réparation de la cassure double brin causée par Cas-9 par les systèmes NHEJ (A) et HDR (B). Pour le système HDR, les séquences de l’ADN donneur homologues de l’ADN à éditer sont en rouge et bleu. Dans cet exemple, on veut insérer dans le gène cible la séquence en vert. Dans le cas de la thérapie par correction de la drépanocytose, le sixième codon GTG de l’allèle muté bêta S est échangé avec le sixième codon GAG de l’ADN donneur.
3. Protocole d’un essai clinique d’édition du génome par correction de la mutation
En 2023, la « Food and drug administration des USA » a autorisé une équipe de médecins des universités de Californie à entreprendre un essai clinique ayant pour objectif de tester le produit qu’ils ont mis au point, le SCD_001. L’objectif de cet essai est de voir si ce « médicament » est efficace et s’il est sûr, ne provoque pas de sérieuses complications.
Le document ci-dessous indique le plan de cet essai
|
Study Type : |
Interventional (Clinical Trial) |
|
Estimated Enrollment : |
9 participants |
|
Allocation: |
N/A |
|
Intervention Model: |
Single Group Assignment |
|
Masking: |
None (Open Label) |
|
Primary Purpose: |
Treatment |
|
Official Title: |
Transplantation of CRISPRCas9 Corrected Hematopoietic Stem Cells (CRISPR_SCD001) in Patients With Severe Sickle Cell Disease |
|
Estimated Study Start Date : |
June 1, 2024 |
|
Estimated Primary Completion Date : |
June 1, 2025 |
|
Estimated Study Completion Date : |
June 1, 2028 |
Detailed Description:
“This is an open label, non-randomized, 2-center, phase 1/2 trial of a single infusion of sickle allele modified CD34+ HSPCs in subjects with severe SCD. The primary endpoint of the trial will determine the safety of CRISPR_SCD001 through a 3+3 design with staggered enrollment and a pause in enrollment for safety review after each of the first 3 patients has had drug product infused. After safety is assessed in the 3rd patient, enrollment of the next 3 patients will not be staggered. The first six subjects will be adults. If CRISPR_SCD001 is determined to be safe in the first six subjects, the trial will continue to enroll 3 adolescents 12 - 18 years of age to evaluate the safety in younger patients. The younger age cohort also will follow staggered enrollment.”
Le produit injecté est constitué par les cellules souches ou les cellules progénitrices dont le génome a été modifié afin d’obtenir la correction dans ces cellules de la mutation cause de la SCD. Pour obtenir cette correction, les médecins ont introduit dans les CSH l’outil d’édition CRISPR-Cas9 ainsi qu’un gène donneur (template) pour que la cellule utilise son système HDR pour réparer la cassure engendrée par Cas9 en corrigeant la mutation bêta S. Ces outils d’édition génique ont été introduits dans les cellules par électroporation. les auteurs disent que c’est le premier essai clinique d’édition du génome qui n’utilise pas de vecteur viral, ce qui devrait diminuer la possibilité de complications.
Les 9 patients retenus ont tous le génotype bêta s/bêta S et présenté durant les deux années des signes d’une drépanocytose sévère : au moins 4 crises vaso-occlusives et 2 épisodes de syndrome thoracique aigu durant les deux années précédentes. Comme cela, l’évolution des caractéristiques cliniques des patients renseignera sur l’efficacité ou non de la thérapie. De nombreux paramètres biologiques : concentration totale de l’hémoglobine, marqueurs de la destruction des globules rouges, paramètres cardiaques et respiratoires, et le ressenti par les patients de la qualité de leur vie… seront évalués durant les 4 années de cet essai de phase 1-2.
B. Conclusion
La thérapie génique de la drépanocytose a connu un très important développement depuis la fin des années 2010 avec des modalités différentes qu’on peut ranger dans deux grandes catégories : la première classique en thérapie est celle de l’addition d‘un gène dans les cellules cibles par l’intermédiaire d’un vecteur viral, la seconde est l’édition du génome par modification d’un gène impliqué dans la maladie avec utilisation d’outil comme le CRISPR-Cas9.
L’évolution en ce début des années 2020 se poursuit. Dans un article de 2021, l’INSERM publie un article intitulé : « Une double thérapie génique dans la drépanocytose ». Le protocole combine l’addition d’un gène thérapeutique aux CSH par l’intermédiaire d’un vecteur lentiviral, à une modification génique par l’intermédiaire de CRISPR Cas9 conduisant à une augmentation de la production d’hémoglobine foetale.
Surtout, une autre technologie appelée base editing se fait jour conduisant à des modifications ponctuelle des séquences géniques sans passer par la cassure de la séquence cible .
Globalement, les essais cliniques les plus avancés ont confirmé l’efficacité des protocoles mais il n’y a pas assez de recul pour voir si les modifications géniques engendrées par ces thérapies dans la lignée érythrocytaire vont persister dans la durée et si des complications inattendues dans le domaine de la santé ne vont pas intervenir.
Plus fondamentalement, en ce qui concerne la drépanocytose, des problèmes humains se posent. C’est une maladie héréditaire qui touche des millions de personnes dans le monde. Chaque année 300.000 enfants drépanocytaires naissent. Or ces traitements de thérapie génique sont très onéreux. La double barrière financière et en termes d’infrastructures semble infranchissable dans les pays pauvres, notamment en Afrique où la fréquence de la maladie est élevée. Le problème de traitements innovants à plusieurs millions d’euros, exigeant des infrastructures bien difficiles à réaliser, est éthiquement posé. Devant cette situation, le diagnostic néonatal qui permet d’instaurer précocement des mesures prophylactiques, notamment de diminuer la susceptibilité aux infections, reste indispensable. En outre, il permet l’identification des nouveaux nés hétérozygotes.
